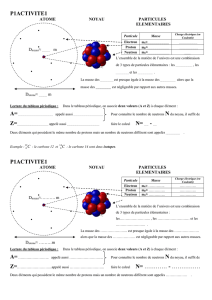
La structure des atomes

2. La structure des atomes
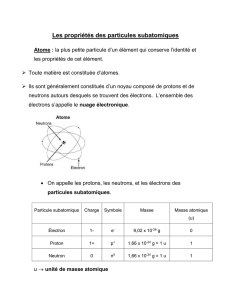
2.1 Les particules subatomiques
Bien que les preuves expérimentales confirment l’existence d’atomes, il se
révéla vite que les atomes ne sont pas autant ‘indivisibles’ que leur nom
l’indique. En effet les atomes sont composés de particules encore plus
petites, les particules subatomiques. Une première preuve expérimentale
de l’existence des particules subatomiques est basée sur l’observation que
les atomes peuvent absorber la lumière et émettre des électrons (effet
photoélectrique). Comme les électrons possèdent une charge négative et que
l’atome est globalement neutre, il suit automatiquement que l’atome doit
également contenir des particules chargées positivement, les protons. Il
s’avère que les atomes ont une masse nettement plus élevée que si l’on
additionne les masses des protons et des électrons le composant. Ce défaut
de masse est dû à la présence d’une troisième particule subatomique, les
neutrons. Le tableau 2.1 résume les propriétés physiques (masse et charge)
des trois particules subatomiques ; l’électron, le proton et le neutron1.
Tab. 2.1 Propriétés physiques des particules subatomiques.
L’électron possède une charge d’une unité de charge élémentaire -1e , ce qui
correspond à 1.602 x 10-19 Coulomb en unités SI. La charge d’un proton est
de +1e. Les protons et les neutrons ont une masse à peu près identique alors
que les electrons sont environ 2000 fois plus léger.
Q
Qu
ue
es
st
ti
io
on
n
2
2.
.1
1:
:
La masse d’un atome de carbone est de 12x1.661x10-27kg. Combien
contient-il de neutrons?
R
Ré
ép
po
on
ns
se
e
2
2.
.1
1:
: 6
2.2 L’intérieur des atomes
Jusqu’ici, nous avons vu que les atomes contiennent des électrons et des
protons, et dans la plupart des cas des neutrons, mais nous ne savons pas
1 Des trois particules subatomiques, seul l’électron est une particule élémentaire (c-à-d. qui n’est pas
formée de plus petites particules). Les protons et les neutrons sont quant à eux composés de 3
particules élémentaires, les quarks.

comment sont arrangées ces particules à l’intérieur de l’atome. Une première
expérience qui suggéra comment les atomes sont construits a été effectuée
par le groupe d’Ernest Rutherford.
Fig. 2.1 Représentation de l’expérience de Rutherford.
Rutherford et ses collaborateurs font passer un faisceau de α-particules
(particules d’hélium doublement chargées, contenant 2 protons et 2 neutrons
4-He2+) provenant d’une source de radon à travers une mince feuille d’or. Le
résultat de cette expérience était vraiment remarquable. Etonnamment, la
plupart des particules α passent la feuille de métal comme si c’était un espace
vide sans collisions et seule une particule sur 20’000 est réfléchie
significativement ! Rutherford interpréta ces données avec un modèle
atomique ou toutes les particules massives (protons et neutrons, aussi
appelés nucléons) sont concentrées dans un tout petit espace, le noyau2
(avec un rayon caractéristique de 10-15m), et où la plupart du volume
atomique est occupé par un nuage électronique étendu dont les dimensions
sont plus grandes typiquement de 4 à 5 ordres de grandeur.
Fig. 2.2 Modèle atomique d’un noyau de protons et neutrons et d’un nuage électronique
étendu. rel/rnucl ~ 104-105.
2 Bien que les protons se repoussent entre eux par forces de Coulomb, les particules du noyau sont
maintenu fermement par la force forte, une autre des quatre force fondamentales.

2.3 Nombre atomique, nombre de masse et isotopes.
Comme toutes les réactions chimiques impliquent des changements dans les
nuages électroniques entourant les noyaux, la nature chimique d’un atome
est déterminée par le nombre de ses électrons. Pour un atome neutre, le
nombre d’électrons nel est égal au nombre de protons np. Comme ce dernier
nombre ne change pas au cours d’une réaction, au contraire du nombre
d’électrons qui peut lui varier, on choisit np comme quantité caractéristique de
la nature chimique d’un atome et on l’appelle le Nombre Atomique (ou le
numéro atomique) Z. Tous 117 éléments connus à ces jours consistent en
des atomes de même nombre atomique Z. Chaque élément est symbolisé par
un symbole chimique (1 ou 2 lettres) comme par exemple H pour hydrogène
ou Na pour le sodium (pour une liste complète de tous les noms et symboles
des éléments consultez :
Liste des éléments par symbole - Wikipédia).
Dans le tableau périodique des éléments ; periodic table of elements (PSE),
tous les éléments sont classés par leur ordre croissant de nombre atomique
Z. Tout atome avec un nombre Z donné peut contenir un nombre variable de
neutrons. Le nombre total de nucléons (protons et neutrons) est appelé le
nombre de masse A. Les atomes avec le même numéro atomique Z mais un
nombre de masse A différent sont appelés isotopes (du grec ‘iso topos’ : ‘au
meme endroit’). Chaque atome avec des nombres Z et A spécifiques est un
isotope, en anglais nuclide. Pour spécifier le type d’isotope on utilise
différentes notations, soit on écrit ‘symbole chimique – A’ ou ‘AZ symbole
chimique’. Un isotope de néon avec 10 protons et 10 neutrons est ainsi décrit
par les notations Ne-20 ou 2010Ne.
Q
Qu
ue
es
st
ti
io
on
n
2
2.
.2
2:
:
Quelle est la notation pour un isotope de néon avec 11 neutrons ? Combien
de neutrons comporte un isotope de Ne-22 ?
R
Ré
ép
po
on
ns
se
e
2
2.
.2
2:
: Ne-21, 12
Tous les isotopes, stables ou instables, ayant été observés sont listés dans
les tables des isotopes. Nous discuterons de quelques isotopes instables
dans le Chapitre 2.5 sur la radioactivité, ici nous nous intéressons aux
isotopes stables d’un élément (si vous suivez le lien donné avant sous tables
des isotopes vous trouverez tous les isotopes stables listés en rouge et si
vous suivez le lien http://www-nds.iaea.org/nudat2/index.jsp et cliquez sur la
gauche sur ‘Nuclear Wallet Cards’ vous pouvez sélectionner un isotope et
trouver son abondance naturelle). Vous noterez que les isotopes stables (en
rouge) sont tous groupés le long du milieu du graphe où le nombre de protons
est à peu près égal au nombre de neutrons, ou, en d’autres mots A ~ 2Z).
Cette zone est appelée îlot de stabilité (island of stability), et la règle A ~ 2Z
vaut surtout pour les éléments légers jusque vers Z = 20, pour Z > 20 les
isotopes stables contiennent progressivement plus de neutrons que de
protons. Il existe aussi des nombres particuliers de protons et neutrons qui
résultent en des isotopes particulièrement stables, les nombres magiques

(‘magic numbers’). Quelques éléments (Be, F, Na, Al, P, Sc, V, Mn, Co, As,
Rb, Y, Nb, Rh, I, Cs, La, Pr, Tb, Ho, Tm, Lu, Ta, Re, et Au) sont pures
isotopiquement ce qui signifie que pour ces éléments, seul un isotope stable
existe. Toutefois, pour la plupart des éléments, il existe au moins 2 ou 3
isotopes stables. Le record est détenu par l’étain pour lequel il existe 10
isotopes stables! Vous pouvez également voir que pour certains éléments il
n’existe que des isotopes instables (p.ex. pour le Tc et le Pm). On appelle ces
derniers des éléments radioactifs. Tous les éléments pour lesquels Z > 83
sont radioactifs.
Tab. 2.2 donne quelques exemples des isotopes naturels de quelques
éléments communs et de leurs abondances naturelles. L’isotope d’hydrogène
moins abondant dans la nature H-2 (aussi appelé hydrogène lourd ou D pour
‘deutérium’ du grec ’deuteros’ = deux) est utilise pour de nombreuses
expériences en chimie (notamment des expériences de résonance
magnétique nucléaire (RMN), en anglais nuclear magnetic resonance (NMR)
ou pour la spectroscopie infrarouge infrared (IR) spectroscopy). Le troisième
isotope naturel H-3 (ou T pour ‘tritium’) est radioactive est n’est donc présent
que sous forme de traces.
L’isotope le plus abondant du carbone est le C-12 (98.9%) et il existe une
petite quantité de C-13 (1.1%). Un troisième isotope naturel est le C-14, un
isotope radioactif utilisé pour dater des échantillons archéologiques.
Tab. 2.2.
Selected
isotopes of
some common
elements.
Q
Qu
ue
es
st
ti
io
on
n
2
2.
.3
3:
:
Combien de formes isotopiques stables (isotopologues) attendez-vous
pour une molécule de C2H2 ? Combien d’entre elles ont une masse
différente ?
R
Ré
ép
po
on
ns
se
e
2
2.
.3
3:
: 9, 5

Les propriétés chimiques d’un atome sont déterminées par le nombre et les
propriétés des électrons qu’il contient. Comme les différents isotopes d’un
élément donné ont tous le même nombre de protons et d’électrons, ainsi que
la même structure électronique, les isotopes présentent un comportement
chimique identique.3 Toutefois, à cause de la différence de masse, des
isotopes différents peuvent avoir des propriétés physiques différentes, comme
par exemple leurs densités, viscosités, coefficients de diffusion, etc.
Q
Qu
ue
es
st
ti
io
on
n
2
2.
.4
4:
:
Quelle différence de densité attendez vous entre l’eau (H2O) et l’eau
lourd (D2O) ?
R
Ré
ép
po
on
ns
se
e
2
2.
.4
4:
: En admettant l’hypothèse que l’eau et l’eau lourde ont une
structure identique, c’est-à-dire qu’un nombre identique de molécules
occupe le même volume, la différence de densité est simplement donnée
par la différence de masse (18 u et 20 u respectivement). On s’attend
donc à une différence d’environ 10 %.
La masse atomique d’un élément est donnée par la moyenne pondérée des
masses de ses isotopes naturels. Les masses atomiques et moléculaires sont
généralement données en unités de masse atomique u. 1 u est défini
comme étant 1⁄12 de la masse d’un atome de carbone-12.
1 u = 1.66054 x 10-27 kg
En biologie et en biochimie, on utilise souvent le terme ‘dalton’ avec le
symbole Da.
1 Da = 1 u
Comme les macromolécules biologiques sont grandes, on les désigne
souvent en kilodaltons, ou “kDa”.
3 L’exception principale à ceci est l’effet cinétique isotopique kinetic isotope effect: à cause de leur
plus grandes masses, des isotopes plus lourds ont tendance à réagir plus lentement que les isotopes plus
légers d’un même élément.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%