Aluminium, Alzheimer : un effet boomerang

Aluminium, Alzheimer : un effet boomerang ?
par Ph. van den Bosch de Aguilar et R.R. Crichton
La détérioration et la perte des fonctions cérébrales au cours du vieillissement portent une atteinte
grave à l’intégrité personnelle mais touchent aussi les sphères familiales et sociales. La démence sénile ou
maladie d’Alzheimer s’annonce comme une manifestation pathologique majeure du vieillissement pour les
décennies à venir. Les facteurs inducteurs de cette pathologie sont encore inconnus. Mais on s’est
intéressé dernièrement à la toxicité possible de l’aluminium...
Le système nerveux et plus particulièrement le cerveau sont considérés comme l’une des structures
les plus compliquées de l’organisme. Cette réputation est sans doute justifiée non pas parce que leurs
constituants sont plus complexes que ceux des autres organes, mais parce que les relations qu’ils établissent
entre eux et avec d’autres systèmes, comme les systèmes endocrinien et immunitaire, font du système
nerveux et du cerveau le centre de régulation de l’ensemble des fonctions vitales, depuis les plus
élémentaires, comme les réflexes, jusqu’aux plus élaborées, comme les comportements ou la réflexion
Des « téléports » dans notre corps
La « gestion » des fonctions vitales par le système nerveux est assurée par une acquisition constante
d’informations sensorielles provenant du corps et de son environnement, par l’intégration de ces
informations dans les centres nerveux et par l’élaboration et l’exécution de réponses adéquates visant à
garantir l’équilibre de l’organisme et de ses relations avec son milieu.
Les messages nerveux sont transportés et transmis par des cellules spécialisées, les neurones.
Comme toutes les autres cellules de l’organisme, les neurones ont un corps cellulaire, mais ils se distinguent
par la présence de prolongements, parfois très longs (jusqu’à un mètre chez l’homme). Ces prolongements,
les synapses, confèrent au système nerveux sa structure particulière en réseau, où tous les éléments sont
interconnectés par le biais des contacts établis entre les prolongements.
Chacun des dix milliards de neurones (au minimum) qui constituent le système nerveux peut ainsi
être en relation avec environ dix mille autres neurones.C’est dans ce réseau que l’information circule,
porteuse de messages sensoriels issus des organes des sens, de messages moteurs destinés aux muscles ou de
messages glandulaires destinés à la régulation des sécrétions internes ou externes.
Placés au sein du réseau neuronal, les centres nerveux représentent des nœuds de réception et
d’émission de messages. Certains ne sont que des relais, d’autres sont spécialisés dans des fonctions
sensorielles ou motrices particulières, d’autres enfin associent et traitent différents types de messages, tant
nerveux qu’endocriniens. En fonction de leur position dans le réseau et de la complexité de leurs
connexions, les centres nerveux ont des compétences hiérarchiques plus ou moins étendues sur la régulation
des fonctions vitales et la prise en charge des activités de l’organisme.
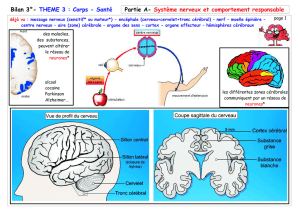
C’est le cortex cérébral, dont l’extension considérable caractérise l’espèce humaine, qui détient, en
dernier ressort, la « décision » neuronale et qui garantit un fonctionnement harmonieux. C’est lui aussi qui
est dépositaire des fonctions supérieures, comme la mémoire et le langage, constituant l’engramme1 de
I’histoire personnelle qui fait de chaque individu un être singulier, de la naissance à la mort
1 L’engramme est le support de la mémoire humaine
L’inné et l’acquis dans le développement neuronal

Au cours de l’embryogenèse, la quantité de cellules nerveuses formées est pléthorique et seules
subsisteront celles qui participent activement à la formation du réseau. Les cellules qui n’entrent pas en
contact entre elles ou avec des organes-cibles, organes sensoriels, muscles ou glandes, seront éliminées.
Cette sélection spécifie Ie réseau neuronal et dépend d’une part d’un déterminisme génétique, qui
définit la structure nerveuse générale de l’espèce : c’est l’inné ; et d’autre part de l’influence de facteurs
épigénétiques, qui modulent finement cette structure ; c’est l’acquis. Des jumeaux identiques n’auront pas
les mêmes réseaux neuronaux. L’influence des facteurs épigénétiques se marque surtout durant les
premières années de la vie, qui forment la période d’apprentissage du réseau neuronal. « Apprendre, c’est
éliminer », selon l’aphorisme célèbre de Jean-Pierre Changeux.
La construction du réseau et son immersion dans l’organisme qu’il parcourt de ses ramifications fixeront le
potentiel neuronal pour le temps de vie de l’individu car, contrairement aux autres cellules, les neurones ne
peuvent être renouvelés et nous héritons notre patrimoine neuronal des premières années de notre vie.
Au cours de la vie, comme les autres cellules, les neurones subissent des altérations et peuvent devenir
déficients. Une perte neuronale normale est estimée à environ dix mille neurones par jour. Si ce tribut peut
paraître lourd, il ne représente pourtant que 3% du potentiel neuronal de départ au cours d’une vie de quatre-
vingts ans. La surabondance neuronale garantit largement les pertes quotidiennes. De plus, le réseau est
plastique et, par l’élimination des connexions inefficaces et l’établissement de nouvelles connexions, il peut
rétablir les mailles manquantes et maintenir les circuits.
Durant la vie adulte, le système nerveux garantit ainsi ses fonctions par un double mécanisme,
l’utilisation de ses réserves, mises en place durant son développement, et la plasticité du réseau, qui assure
les remplacements et les compensations. C’est dans cette dynamique d’altérations et de compensations que
s’inscrit le vieillissement nerveux. Il sera le fruit, dans la toile de fond génétique, des accrocs et déchirures
de la vie personnelle.
Mécanismes du vieillissement cérébral
Comme les autres tissus de l’organisme, le tissu nerveux vieillissant est soumis à diverses agressions
et dérives métaboliques. Mieux protégé et manifestement mieux armé pour s’en défendre, il bénéficie en
plus de stratégies de remplacement et d’alternatives de secours. Celles-ci devraient lui permettre de résister
le temps d’une vie. Mais les résistances peuvent être mises en défaut et la détérioration des fonctions
cérébrales, jusqu’alors latente et inapparente, devient brutale et manifeste.
Trois phénomènes majeurs marquent le virage vers la détérioration. Le premier est l’augmentation
de la perte des neurones. Lorsque celle-ci affecte des régions où l’information est redondante, la perte
neuronale n’aura que des effets discrets. Par contre, lorsque la dépopulation neuronale atteint des centres
nerveux stratégiques, à faible nombre de neurones et possédant un large spectre de relations, une perte
même mineure aura des conséquences drastiques, dont l’impact sera d’autant plus grand que les centres
touchés interviennent dans la régulation d’un grand nombre de fonctions, non seulement nerveuses mais
aussi endocriniennes et immunitaires. C’est donc plus la localisation des pertes que leur quantité qui
importe. L’appauvrissement du réseau neuronal, qui rend silencieux des voies et des centres nerveux, est à
la base des dysfonctionnements nerveux manifestes. Bénéfiques au cours de la neurogenèse, car elle
spécifie le réseau, la raréfaction neuronale se révèle dramatique au cours du vieillissement, car elle soustrait
du réseau des voies spécifiques : le réseau désapprend.
Les deux autres phénomènes entraînent la perte neuronale par le dépôt de substances anormales
dans les neurones eux-mêmes. Les enchevêtrements neurofibrillaires sont des accumulations de faisceaux
denses de filaments associés en torsades et constitués de la protéine tau. Leur présence bloque le
métabolisme du neurone, entraînant sa dégénérescence.
L’amyloïde, quant à elle, est une protéine dont les sous-unités sont disposées selon une
conformation plissée. Elle forme des fibrilles qui s’étendent entre les cellules nerveuses, détruisant leurs

prolongements et interrompant ainsi le réseau neuronal. Ces dépôts d’amyloïde, engluant des structures
nerveuses dégénérées, forment les plaques séniles, caractéristiques du cerveau âgé. Les facteurs inducteurs
de ces altérations sont encore énigmatiques mais celles-ci affectent de façon privilégiée les territoires
cérébraux responsables des fonctions supérieures, comme les aires d’associations (qui coordonnent les
fonctions cérébrales) et l’hippocampe (qui intervient dans la mémorisation).
Dans une perspective évolutive, les territoires qui détiennent la spécificité du cerveau humain
contiendraient ainsi les germes de leur propre destruction ! Ces altérations sont présentes chez toute
personne âgée et rendent compte des oublis et des troubles bénins qui accompagnent le vieillissement
normal. Leur extension peut conduire à la pathologie de la démence sénile ou maladie d’Alzheimer.
Qu’est-ce que la maladie d’Alzheimer ?
Décrite par Alois Alzheimer en 1907, la pathologie qui porte son nom est manifestée par un accroissement
progressif de troubles de la mémoire, par des modifications de la personnalité, par des troubles du langage et
par le retrait du monde extérieur. Elle évolue sur plusieurs années et conduit à la mort du patient. Quelques
chiffres situent le problème. Son incidence est liée à l’âge ; elle touche 5% des personnes âgées de plus de
60 ans et 35% de personnes de plus de 85 ans. Aux États-Unis, le diagnostic et Ies soins aux patients sont
estimés à environ 2.000 milliards de francs. Il n’existe actuellement aucun moyen de guérir ni de freiner
l’évolution de la maladie.
De même que les causes des altérations cérébrales au cours du vieillissement normal, les
mécanismes qui entraînent la pathologie démentielle sont inconnus. Les deux phénomènes sont d'ailleurs
étroitement liés ; la démence s’installant dans un cerveau âgé pourrait représenter une exacerbation du
processus de vieillissement. Plusieurs hypothèses sont proposées.
La démence a-t-elle une cause génétique ? Comme certaines familles présentent une incidence plus
importante de démence, des facteurs génétiques ont été mis en cause. Dans ces cas de démence familiale, le
tableau pathologique est le même que dans Ies cas sporadiques et une anomalie génétique est détectée sur le
chromosome 21. Ce chromosome porte aussi le gène qui code pour la protéine amyloïde, mais les deux
gènes ne sont pas liés. D’autre part, les patients mongoliens (trisomie 21) présentent en vieillissant des
lésions comparables à celles qui sont observées au cours de la démence. Par contre, les jumeaux vrais sont
rarement atteints tous deux de démence. Si ces données plaident bien en faveur de facteurs génétiques, ceux-
ci n’interviendraient pas seuls, mais pourraient constituer un terrain prédisposant à la morbidité.
La démence a-t-elle une origine infectieuse ? Cette hypothèse résulte de l’existence de démences
transmissibles chez l’homme (maladie de Creutzfeldt-Jakob) et chez l’animal (maladie des vaches folles).
Mais actuellement, aucune donnée ne justifie la nature infectieuse de la maladie d’Alzheimer.
La démence est-elle due à des agents toxiques ? On sait depuis longtemps que certains métaux,
comme le plomb, le mercure et l’aluminium, sont particulièrement toxiques pour le cerveau. Dans la
maladie d’Alzheimer, seul l’aluminium pourrait être impliqué. En effet, le cerveau des patients contient des
taux anormalement élevés de ce métal, concentré sous forme d’aluminosilicates insolubles, dans les
neurones et les plaques séniles. Plusieurs observations plaident en faveur d’une action de ce métal.
L’aluminium au banc des accusés
Des données récentes ont montré que l’incidence de la maladie est augmentée dans les régions à
haute teneur en aluminium dans l’eau domestique. Des formes de démence peuvent être observées chez les
hémodialysés (qui subissent un apport important de sels d’aluminium) et après abus de pansements
gastriques à base d’aluminium. Par ailleurs, l’administration d’un chélateur2 de l’aluminium réduit
significativement le déclin des performances des patients déments.
2. Chélateur : substance qui fixe de métal et qui le neutralise.
L’aluminium est un des éléments les plus abondants de la biosphère et il est présent non seulement
dans l’eau courante mais aussi dans les tissus animaux et végétaux. En plus de l’eau domestique, certains
aliments en contiennent des quantités particulièrement importantes, soit qu’il y soit présent naturellement,

comme dans le thé, soit comme additif, pour exalter la sapidité (pâtisseries) ou pour assurer la conservation
et le stockage (jus de fruits, lait en poudre pour bébés).
Sans compter certaines pâtes dentifrices qui contiennent plus d’aluminium que l’eau de boisson.
Son absorption par la paroi du tube digestif est grandement facilitée en milieu acide, en présence de
citrate par exemple. Dans le sang, il est transporté en grande partie par la transferrine, en se substituant au
fer. En cas de surcharge, l’aluminium porté par la transferrine peut être distribué aux organes et en
particulier au cerveau, qui possèdent des récepteurs liant la transferrine. Curieusement, ces récepteurs sont
particulièrement abondants dans les régions touchées par la démence.
La voie d’entrée digestive n’est pas la seule possible. Les poussières de silicates d’aluminium
générées par l'exploitation industrielle pourraient atteindre Ie cerveau par la voie olfactive au travers de la
muqueuse nasale. C’est la seule voie neuronale qui ne jouit d’aucune protection et les récepteurs olfactifs
constituent une fenêtre nerveuse directement ouverte vers le monde extérieur. Le cerveau pourrait ainsi être
imprégné d’aluminium apporté par voie nerveuse et par voie sanguine.
Tant dans la perspective du vieillissement cérébral normal que pathologique, l’aluminium pourrait
donc représenter, sinon le facteur inducteur, du moins un facteur insidieux, favorable à l’installation et à
l’extension des dégradations ainsi qu’à la perte de neurones.
L’aluminium n’a naturellement aucune fonction biologique connue. Extrait du milieu pour être
exploité par l’homme, il exercerait ainsi un effet « boomerang » aussi redoutable qu’inattendu sur les
structures cérébrales qui ont permis son exploitation ...
1
/
4
100%