TD CHAPITRE 9 : β-‐ELIMINATIONS

!"#$%&'()*)+),-%.%/#&%0/1)))))))))))))))))))))))2(345'()6789:678;)
!
8)
<=)!>?@A<B,)*)+)β:,2ACAD?<AEDF)!
!
Ce!qu’il!faut!savoir!:!
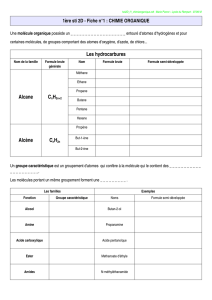
=G3%/%&%0/)H(1).0&1)+)'GI%01G-(J&%5(K)1&G'G01G-(J&%5(K)1&G'G01$GJ%3%LM()
N%-#/K)J0/H%&%0/1)0$G'#&0%'(1K)1G-(J&%5%&G)(&).GJ#/%1.()H()-#),6)
!
Ce!qu’il!faut!savoir!faire!:!
O&%-%1(')-()30'.#-%1.()H(1)3-4J"(1)J0M'P(1)$0M')HGJ'%'()M/).GJ#/%1.()(/)J"%.%()0'I#/%LM()
F#50%')&'0M5(')-(1)$'0HM%&1)%11M1)HQM/()'G#J&%0/)R(/)&(/#/&)J0.$&()H()-#)1&G'G01G-(J&%5%&GK)(&)H()-#)'GI%01G-(J&%5%&GST)
)
Erreurs!à!éviter!et!conseils!
)
!
Pour!s’entrainer…!
Exercice!1!:!E2!
8S B($'G1(/&(')-()R6FK)UBS:6:P'0.0:U:.G&"V-$(/&#/()RJ0.$01G)AS)(/)J0/5(/&%0/)H()!'#.T)
6S E/) 3#%&) 'G#I%') W) J"#MH) H() -QG&"#/0-#&() H() 10H%M.) )H#/1) -QG&"#/0-) 1M') -() J0.$01G) A)1M%5#/&) M/()
'G#J&%0/)HM)H(MX%4.()0'H'(T)E/)0P&%(/&)H(MX)"VH'0J#'PM'(1)%10.4'(1)+)B).#Y0'%&#%'(.(/&)(&)CT)
#S ZM(-)(1&)-()&V$()H()'G#J&%0/).%1()(/)Y(M)[)ZM(-)-().GJ#/%1.()3#50'%1G)[)\M1&%3%('T)
PS =0//(')-(1)30'.M-(1)H(1)$'0HM%&1)30'.G1!1#/1)0.(&&'()-#)1&G'G0J"%.%(T)
JS ZM(-)(1&)-()$'0HM%&)B)[)@0M'LM0%)-()J0.$01G)B)(1&:%-)0P&(/M).#Y0'%&#%'(.(/&)[)\M1&%3%('T))
HS ,J'%'()-().GJ#/%1.()H()-#)30'.#&%0/)HM)$'0HM%&)B)(/)3#%1#/&)#$$#'#]&'()J-#%'(.(/&)-()HG'0M-(.(/&)1&G'G0J"%.%LM()H()-#)
'G#J&%0/T))
(S F%)-Q0/)3#%&)'G#I%')H()-#).^.()3#_0/)-()J0.$01G)A’)R1&G'G0:%10.4'()H()J0/3%IM'#&%0/)H()AS))H()J0/3%IM'#&%0/)R6FK)UFSK)LM(-)
$'0HM%&).#Y0'%&#%'()0P&%(/&:0/[)2()H(11%/(')1#/1)0MP-%(')-#)1&G'G0J"%.%(T))
3S ,/)HGHM%'()M/)#HY(J&%3)$('.(&&#/&)H()LM#-%3%(')-#)'G#J&%0/).%1()(/)Y(MT)=G3%/%')J(&)#HY(J&%3T))
)
Exercice!2!:!Sélectivité!d’une!élimination!
2()R6FS:6:P'0.0:8:$"G/V-$'0$#/(K)J"#M33G)(/)$'G1(/J()HQM/()10-M&%0/)H()10MH()J0/J(/&'G(K)J0/HM%&)$#')M/()'G#J&%0/)HM)1(J0/H)
0'H'()W)H(MX)1&G'G0%10.4'(1)E!(&)F)(&)W)M/)H()-(M'1)%10.4'(1)H()J0/1&%&M&%0/)GK)H()10'&()LM()`G)a`F)a)`ET)E/)0P&%(/&)H(1)&'#J(1)
HQM/)#M&'()J0.$01G)0$&%LM(.(/&)#J&%3T)
)
8S ,J'%'()-(1)30'.M-(1)H()EK)F)(&)GT))
6S \M1&%3%(')LM()E)(1&)0P&(/M).#Y0'%&#%'(.(/&T),/0/J(')-#)'4I-()#$$'0$'%G(T))
US =() LM(-) &V$() H() .GJ#/%1.() 1Q#I%&:%-) [) ,J'%'() -() .GJ#/%1.() H() 30'.#&%0/) H() E)RH#/1) -Q(1$#J(S) H() .#/%4'() W) .0/&'(')
J-#%'(.(/&)-()HG'0M-(.(/&)1&G'G0J"%.%LM(T))
9S ZM(-)(1&)J()b)J0.$01G)0$&%LM(.(/&)#J&%3)c)H0/&)0/)0P&%(/&)H(1)&'#J(1)[)
)
)
)
)
H2C O
H3C, Na+
Br
HO
Δ
Na+,E + F + G
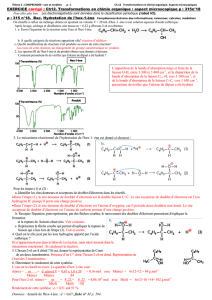
!!!!!!!!!!!!!!!Lors!d’une!élimination!E2,!comment!savoir!quels!
seront!les!produits!formés!?!
8S 2#)'G#J&%0/)(1&)1&G'G01$GJ%3%LM()+)#&&(/&%0/)#M) J#1) 0d)
-(1) J#'P0/(1) e) (&) f) 10/&) #1V.G&'%LM(1K) -#) H0MP-()
-%#%10/)30'.G()#M'#)M/()J0/3%IM'#&%0/)$'GJ%1()Rg)0M),S)
6S 2#) 'G#J&%0/) (1&) 'GI%01G-(J&%5(K) (--() 1M%&) -#) '4I-() H()
g#h&1(5)+)1%)$-M1%(M'1)$'0HM%&1)$(M5(/&)^&'()0P&(/M1K)-()
$'0HM%&) .#Y0'%&#%'() (1&) -() HG'%5G) G&"V-G/%LM() -() $-M1)
1&#P-(T)
,X(.$-()+))
)
)
)
)
)
)
Br
H
H5C2
CH3
H3C
H
_
_
_
Et-O
_
_
_
_
_
Et-OH
H5C2CH3
H3C H
Br
_
_
_
_
α
β1α
Z
Majoritaire
β2
β1
β2
H5C2
CH2
H3C
H
α
Minoritaire
β1
β2
HH3CCH3
H5C2H
αβ
E
Pas obtenu, seul le
diastéréoisomère Z peut être
obtenu par un mécanisme E2 à
partir de ce substrat (réaction
stéréospécifique)
Δ
_
_
Et-OH
Si#H#arraché#sur#le#
carbone#β2#
#Si#H#arraché#sur#le#
carbone#β1#

!"#$%&'()*)+),-%.%/#&%0/1)))))))))))))))))))))))2(345'()6789:678;)
!
6)
Pour!aller!plus!loin!
Exercice!3!:!Rétrosynthèses!
=G&('.%/(')-#)1&'MJ&M'()H(1)HG'%5G1)P'0.G1)LM%)H0//(/&)-Q#-J4/()1M%5#/&)J0..()$'0HM%&).#Y0'%&#%'()HQM/()G-%.%/#&%0/),6)+))
8S 6:.G&"V-PM&:6:4/())))
6S PM&:8:4/())))
US RgS:U:.G&"V-$(/&:6:4/()
9S 8:.G&"V-JVJ-0"(X4/()
)
Exercice!4!:!Compétition!SNME!!
E/) 3#%&) 'G#I%')H() -QG&"#/0-#&() H() 10H%M.) 1M') -() 1&G'G0%10.4'() B) HM) 6:P'0.0:U:.G&"V-PM&#/(T) E/) %10-() &'0%1) J0.$01G1)+) H(MX)
"VH'0J#'PM'(1)%10.4'(1)?)(&)NK)H()30'.M-()P'M&()!;>87)(&)M/)J0.$01G)J"%'#-)!)R!i>8jEST)
8S ZM(--()(1&)-#).0-GJM-#'%&G)H(1)'G#J&%0/1)#V#/&)-%(M)[)
6S =0//(')-(1)30'.M-(1)H()?K)N)(&)!K)1#J"#/&)LM()?)(1&)0P&(/M).#Y0'%&#%'(.(/&)$#')'#$$0'&)W)NT)
US =0//(')-().GJ#/%1.()HQ0P&(/&%0/)H()?)(&)!T))
9S !0..(/&)#MI.(/&(')-#)$'0$0'&%0/)H()?)(&)N)$#')'#$$0'&)W)!)[)
)
?)B,D=B,)
Exercice!5!:!Elimination!sur!composés!cycliques!
<'#%&G)$#')M/()P#1()30'&()J0/J(/&'G():)-QG&"#/0-#&()H()10H%M.) :)H#/1)-kG&"#/0-)(/)J"#M33#/&)W);;l!K))-()
J"-0'M'() H() .(/&"V-() I)H0//() 877`) HQM/) "VH'0J#'PM'() A)#-0'1) LM() -() J"-0'M'() H() /G0.(/&"V-() II)H0//() i;`) HQM/) #M&'()
"VH'0J#'PM'()B)(&)6;`)H()AT))
)
8S B($'G1(/&(')-(1)J0.$01G1)A)(&)B)(/)'($'G1(/&#&%0/)H()!'#.)&0$0-0I%LM()(/)$'GJ%1#/&)-()&V$()H().GJ#/%1.().%1)(/)Y(MT)
6S @0M'LM0%)0P&%(/&:0/)1(M-(.(/&)A)$#'&%')H()I)H#/1)J(1)J0/H%&%0/1)(X$G'%.(/&#-(1)[)\M1&%3%(')10%I/(M1(.(/&)-#)'G$0/1(T))
US =#/1)-()J#1)H()-QG-%.%/#&%0/)1M')-()J"-0'M'()H()/G0.(/&"V-()IIK)YM1&%3%(')1%.$-(.(/&)LM()B)(1&)0P&(/M).#Y0'%&#%'(.(/&)
H(5#/&)AT)
9S F%)0/)'(.$-#J()-QG&"#/0-#&()H()10H%M.)$#')HM)&('&%0PM-&V-#&()H()$0%M.)RC(U!:E:K)mnSK)J0..(/&)G50-M()-()'#$$0'&)
H(1)LM#/&%&G1)H().#&%4'(1)H()?)(&)N)0P&(/M1)-0'1)H()-#)'G#J&%0/)1M')AA)[))
;S 2#)'G#J&%0/)I!!!A!(1&)977)30%1)$-M1)-(/&()LM()II!!!A!H#/1)J(1).^.(1)J0/H%&%0/1)(X$G'%.(/&#-(1T)A/&('$'G&(')J()'G1M-&#&T))
)
H2C O
H3C, Na+
Cl
I II
Cl
1
/
2
100%