PROPHYLAXIEInfos Numéro spécial halitose

Numéro spécial halitose
Nouvelle solution contre la mauvaise haleine:
bain de bouche méridol HALITOSIS
Epidémiologie – diagnostic
Efficacité clinique du bain de bouche méridol HALITOSIS
PROPHYLAXIE
Infos
Informations pratiques sur la prévention en hygiène bucco-dentaire

02 Numéro spécial PROPHYLAXIEInfos
Mentions légales/Sommaire/Éditorial
Éditorial
Chères lectrices, chers lecteurs,
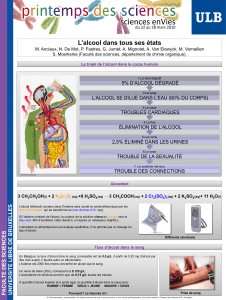
Près de 25% des individus souffrent à certains
moments de la journée d’une mauvaise haleine sociale-
ment inacceptable. Chez beaucoup des personnes concer-
nées, cette mauvaise haleine complique les relations avec
les autres. En même temps, il existe des produits qui peu-
vent résoudre efficacement et durablement le problème
de la mauvaise haleine (halitose). La nouvelle solution
bucco-dentaire méridol HALITOSIS lutte contre les causes
de la mauvaise haleine grâce à une combinaison des prin-
cipes actifs fluorure d’étain/fluorure d’amines, lactate de
zinc et d’agents actifs brevetés destinés à réduire la mau-
vaise haleine.
Les chiffres cités précédemment sont alarmants car ils
font état du manque d’information des patients souffrant
de cette affection.
Le conseil du dentiste est absolument indispensable; la
plupart des patients acceptent facilement l’aide de leur
dentiste après avoir évoqué le problème. Ils savent pou-
voir compter sur une aide compétente et sont prêts à
aborder des sujets de santé parfois encore tabous. Cela
est particulièrement vrai pour les patients souffrant d’hali-
tose parfois affligés d’un handicap considérable dans leurs
relations sociales.
GABA, spécialiste de la prévention bucco-dentaire, con
-
sacre
une édition spéciale de son journal PROPHYLAXIE-
Infos à l’halitose afin de mieux sensibiliser les profession-
nels à cette affection.
GABA a également choisi ce thème lors des différents
symposiums organisés à l’occasion de conf
érences inter-
nationales renommées. A l’issue d’Europério 6 notamment,
les informations sur le symposium Halitose ont été mises en
ligne sur www.gaba.com/europerio.
Enfin, je voudrais attirer votre attention sur une autre
innovation sur Internet: depuis le 30 avril 2009, notre
magazine est disponible sur notre site (www.gaba.com/
prophylaxedialog) dans sa version anglaise et tout bientôt
dans sa version française.
Cordialement,
Dr Marianne Le Reste
Directrice du d
épartement
Affaires Scientifiques
GABA France
Éditeur (Responsable en vertu du droit de presse):
GABA Laboratoires
60, avenue de l’Europe
92270 Bois-Colombes
Directeur Affaires Scientifiques: Marianne Le Reste
Directeur Marketing: Marie-Agnès Richard
Internet:
www.gaba.com
Conception:
eye-con Medienagentur
Lechenicher Str. 29 · 50374 Erftstadt · Allemagne
L’opinion des auteurs ne reflète pas nécessairement
celle de l’éditeur. La reproduction et la publication
d’extraits sont autorisées sous réserve de citation de
la source.
Cristaux de soufre –
recristallisés après fusion
Microscopie optique/
lumière polarisée/x80
Source: Kage-Mikrofotografie
Sommaire
Nouvelle solution contre la mauvaise haleine:
le bain de bouche méridol HALITOSIS 3
L’halitose: définition et épidémiologie 4
Pr Dr Marc Quirynen, Louvain, Belgique
La consultation professionnelle pour l’halitose 7
Pr Dr Andreas Filippi, Bâle, Suisse
Méthodes analytiques pour le diagnostic de l’halitose 11
Dr Ben de Lacy Costello, Pr Dr Norman Ratcliffe,
Bristol, Grande Bretagne
Micro-organismes de la langue et mauvaise haleine:
la densité microbienne est-elle plus importante
que les espèces microbiennes? 15
Pr Dr John Greenman, Dr Saliah Saad,
Bristol, Grande Bretagne
L’halitose: un problème pluridisciplinaire 18
Dr Curd M. L. Bollen, Pr Dr Søren Jepsen, Bonn,
Allemagne
Composés malodorants de l’halitose buccale:
un lien avec la parodontite et le cancer 22
Pr Ken Yaegaki DDS, Ph.D, Tokyo, Japon
La lutte contre l’halitose – Résultats d’études 26
Pr Dr Klaus-Peter Wilhelm, Hambourg, Allemagne
Mauvaise haleine et bain de bouche
méridol HALITOSIS 28
Bärbel Kiene, Directeur Affaires Scientifiques,
GABA International, Suisse

PROPHYLAXIEInfos Numéro spécial 30
Une étude in vivo de 3 semaines le prouve: un
nouveau produit peut réduire de façon décisive la
mauvaise haleine.
L’halitose résulte principalement de la décompo-
sition bactérienne de matières organiques dans la
cavité buccale. Ce processus entraîne la formation de
composés sulfurés volatils (en anglais volatile sulphur
compounds (VSC)), principaux responsables de la mau-
vaise haleine. L’affection peut être analysée et quanti-
fiée par des mesures organoleptiques. Un examinateur
formé sent le souffle du patient et évalue sa mauvaise
haleine. La plupart des patients souffrant d’halitose
présentent des scores organoleptiques élevés; l’hali-
tose est souvent un obstacle important aux relations
sociales des patients affectés.
L’utilisation deux fois par jour du bain de bouche
méridol HALITOSIS entraîne une nette réduction de la
mauvaise haleine chez les patients présentant des
valeurs organoleptiques et de VSC élevées. C’est le
résultat d’une étude scientifique que le Dr Walter
Wigger-Alberti a menée avec son équipe de l’Institut
proDERM de Recherche Dermatologique Appliquée.
Dans cette étude clinique randomisée, stratifiée, en
double aveugle de 3 semaines, l’efficacité de la solu-
tion bucco-dentaire méridol HALITOSIS a été testée sur
des sujets qui souffraient de mauvaise haleine. Les 174
sujets qui ont participé à cette étude ont été divisés en
un groupe test et trois groupes de contrôle de même
taille. Les sujets d’expérience présentaient aussi bien
une valeur organoleptique initiale élevée qu’une forte
concentration de sulfure d’hydrogène dans l’haleine.
Les participants ont été stratifiés selon leur valeur orga-
noleptique initiale.
Dans tous les groupes, les participants se sont bros-
sés les dents deux fois par jour avec une brosse à dents
méridol et un dentifrice classique contenant une teneur
en fluorure de 1400 ppm. En outre, le groupe test
devait pratiquer un rinçage buccal avec le bain de
bouche méridol HALITOSIS. Les groupes témoin
positifs ont utilisé d’une part un bain de bouche anti-
septique et d’autre part un bain de bouche à base de
chlorhexidine alors que le groupe témoin négatif utili-
sait de l’eau du robinet. Les données ont été collectées
aux jours 1, 7 et 21.
Chez les sujets qui ont utilisé le bain de bouche
méridol HALITOSIS, une réduction significative des
valeurs organoleptiques a été observée dès le lende-
main de la première utilisation. Par rapport au groupe
contrôle négatif, les valeurs de VSC des utilisateurs
du bain de bouche méridol HALITOSIS ont diminué
de plus de 50% après le premier jour d’utilisation. La
baisse des valeurs a même dépassé le seuil de détec-
tion clinique. Cet effet positif est resté constant au
cours de l’étude, comme l’ont montré les collectes de
données après le septième et le vingt et unième jour.
L’intervalle de confiance était de 95%.
«Les bons résultats du bain de bouche méridol
HALITOSIS sont dus aux principes actifs fluorure
d’étain, fluorure d’amines et lactate de zinc. Cette com-
binaison d’agents actifs combat activement les bacté-
ries responsables des odeurs et les composés soufrés
volatils qui sont considérés comme la cause principale
de la mauvaise haleine», explique Bärbel Kiene,
Directrice Affaires Scientifiques GABA International.
«De plus, le fluorure contenu dans le bain de bouche
méridol HALITOSIS offre une protection efficace contre
les caries. Le dernier produit issu de la recherche méri-
dol permet donc aux patients de lutter efficacement
contre la mauvaise haleine sans pour autant négliger
les autres aspects d’une hygiène buccale optimale.»
Numéro spécial halitose
Nouvelle solution contre la mauvaise haleine:
le bain de bouche méridol HALITOSIS

44 Numéro spécial PROPHYLAXIEInfos
Numéro spécial halitose
Définition de l’halitose
L’haleine peut être définie comme la perception
subjective de l’odeur de l’air expiré par une personne,
laquelle peut être ressentie comme agréable, désa-
gréable ou même repoussante. Lorsque l’odeur perçue
est désagréable, on parle d’«halitose» (du latin «hali-
tus» pour haleine), de mauvaise haleine ou de foetor ex
ore. Ces expressions ne sont cependant pas toutes
synonymes de mauvaise odeur buccale qui a son ori-
gine dans la cavité buccale, car certaines halitoses
ont des causes extra-buccales.
Lorsque l’on parle de mauvaise haleine, on ne
pense habituellement pas aux odeurs passagères qui
sont dues à l’alimentation (par exemple l’ail, les
oignons ou différentes épices), au tabac ou à la prise de
médicaments (par exemple la cyclosporine), à la mau-
vaise haleine temporaire du matin qui est provoquée
par le taux de salivation réduit et qui disparaît sponta-
nément après le brossage des dents ou le petit-déjeu-
ner. Une mauvaise haleine persistante a en principe
toujours des causes pathologiques (Quirynen & van
Steenberghe 2003).
On distingue trois catégories d’halitose, à savoir
l’halitose vraie, la pseudo-halitose et l’halitophobie
(Yaegaki & Coil 2000). L’halitose vraie décrit un état
dans lequel la mauvaise haleine existe objectivement;
elle peut être mise en évidence par un examen organo-
leptique ou par une analyse à l’aide d’instruments.
Chaque fois qu’une mauvaise haleine ne peut pas être
perçue, bien que le patient soit persuadé d’avoir mau-
vaise haleine, on parle de pseudo-halitose.
Si, après le traitement d’une halitose vraie ou le dia-
gnostic d’une pseudo-halitose, le patient continue à
croire qu’il souffre de mauvaise haleine, il s’agit d’une
halitophobie qui compte parmi les troubles obsession-
nels psychiatriques. Il ne faudrait pas sous-estimer l’im-
portance de l’halitophobie. Dans une étude réalisée
entre 1995 et 2008 à l’Université de Louvain, lors de
laquelle 2000 patients se sont rendus à la consultation
pluridisciplinaire pour halitose, il est apparu que près
de 16% des participants souffraient de pseudo-halitose
voire d’halitophobie (Quirynen et al. 2009).
Epidémiologie de l’halitose
La mauvaise haleine a déjà été observée il y a mille
ans et elle apparaît même dans les œuvres d’écrivains
grecs et romains. La mauvaise haleine est évoquée
dans le Talmud juif comme dans la religion islamique.
On peut aujourd’hui considérer un manuscrit de J. W.
Howe de l’année 1898 comme le premier des articles
modernes sur le sujet.
Bien que l’halitose soit partout dans le monde une
question d’une importante portée socioéconomique,
elle a été dans une large mesure négligée par les scien-
tifiques et les médecins jusqu’à un passé récent. Dans
notre société, la mauvaise haleine constitue toujours
l’un des tabous les plus forts, ce qui se reflète dans le
fait que la plupart des patients qui se rendent à une
consultation pour mauvaise haleine en souffraient déjà
depuis quelques années avant de rechercher une aide
professionnelle.
Une étude récemment réalisée à Louvain, à laquelle
2000 patients ont participé, a montré que plus de 90%
de l’échantillon se plaignaient de troubles depuis au
moins un an et que 16% en souffraient jusqu’à 15 ans
auparavant. La plupart d’entre eux avaient consulté un
chirurgien-dentiste ou un stomatologue. Cela montre
qu’il existe toujours un manque d’information, non seu-
lement chez les patients, mais aussi dans la profession.
L’un des aspects les plus étranges de l’halitose est
qu’une personne ne peut normalement pas sentir sa
propre haleine, ce que l’on désigne par le «bad-breath
paradox» (Spogue 1964; Rosenberg 1997). De nom-
breux patients halitosiques ne sont pas conscients de
leur mauvaise haleine tandis que d’autres sont persua-
dés à tort d’avoir mauvaise haleine. Des études mon-
trent que la perception de sa propre haleine est extrê-
mement peu fiable (Rosenberg et al. 1995). De façon
générale, les patients sont incapables de classer objec-
tivement leur haleine sur une échelle. Les études
basées sur des auto-évaluations ne sont donc pas
fiables pour évaluer la mauvaise haleine en raison de
leur faible sensibilité et de leur manque de précision.
Prévalence
Les aspects qui viennent d’être mentionnés expli-
quent pourquoi il y a peu d’études sur la prévalence de
la mauvaise haleine. Le problème est donc insuffisam-
ment documenté dans la plupart des pays. L’American
Dental Association (ADA) a publié en 2003 un rapport
selon lequel 25% de la population américaine souffri-
raient de mauvaise haleine permanente.
Des études de grande envergure, basées sur des
approches différentes ont été réalisées sur les popula-
tions japonaise (Miyazaki et al. 1995), suédoise (Söder
et al. 2000) et chinoise (Liu et al. 2006). Des enquêtes
plus modestes ont été menées au Brésil (Nadanovsky et
al. 2007), en Pologne (Iwanicka-Grzegorek et al. 2005)
et en Israël (Knaan et al. 2002). Un résumé reprenant les
principales informations fournies par ces études est
présenté dans le tableau ci-après.
L’halitose: définition et épidémiologie
Pr Dr Marc Quirynen, Université catholique de Louvain, Belgique

Numéro spécial halitose
PROPHYLAXIEInfos Numéro spécial 50
Principales publications sur la prévalence de l’halitose
Auteur(s) Pays NGroupe de population Critères Prévalence
Age: 18–64
(moyenne 39 ans) 14% (EMG)
Miyazaki et al. 1995 Japon 2672 Féminin: 64% VSC >_ 75 ppb 23% (LMG)
Relevé: 6% (EAG)
examen de routine annuel 16% (LAG)
Age: moyenne 36 ans «Odeur forte provenant
Féminin: 50% de la bouche du patient, qui avait 2,4%Söder et al. 2000 Suède 1681 Relevé: un effet sur l’examinateur et
Centre dentaire communautaire rendait l’examen insupportable.»
Age: 18–74 10,97% (18–24 ans)
(moyenne 39 ans) 29,68% (25–34 ans)
Iwanicka-Grzegorek et al. Pologne 295 Féminin: 68% VSC >_ 125 ppb, OS >_ 218,06% (35–44 ans)
2005 Relevé: au Département de 24,52% (45–54 ans)
médecine dentaire conservative 16,77% (55–64 ans)
Age: 20–55
(moyenne 37 ans)
Knaan et al. 2005 Israël 88 Féminin: 50% OS >_ 229,8%
Relevé: examen médical
de routine
Age: 15–64 OS >_ 2 (1) 27,5% (1)
Liu et al. 2006 Chine 2000 Féminin: 50% VSC >_ 75 ppb (2) 20,3% (2)
Relevé: aléatoireVSC >_ 110 ppb (3) 35,4% (3)
Age: < 20 – > 60 «Selon vous, combien de personnes
Nadanovsky et al. 2007 Brésil 344 Féminin: 51% vivant dans votre foyer ont mauvaise 15%
Relevé: interview téléphonique haleine (vous-même excepté)?»
de 118 étudiants universitaires
VSC (Volatile Sulphur Compounds): composés soufrés volatils; ppb: parties par billion; OS: valeur organoleptique
EMG/LMG: Groupe début / fin de matinée (dans les deux heures ou après deux heures après la dernière ingestion de nourriture ou d’hygiène orale le matin)
EAG/LAG: Groupe début / fin d’après-midi (dans les deux heures ou après deux heures après ingestion de nourriture ou d’hygiène orale l’après midi)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%