masse de cuivre dans une pièce de 10 centimes

!
Activité expérimentale 6
Quelle masse de cuivre
contient une pièce de 10
centimes d’euro ?
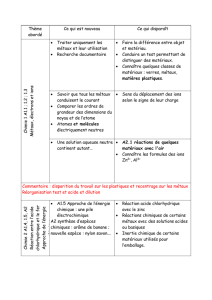
Dans%le%programme%de%la%classe%de%PCSI%:%%
!
!
!
Pour! répondre! à! la! question! donnant! son! titre! à! notre! activité,! voici! quelques! documents,!
provenant!de!diverses!sources,!qui!peuvent!être!utiles!:!
!
Document Wikipédia
La!pièce&de&10¢imes!est!composée!d'un!alliage,!appelé!or&nordique!(ou!alliage!nordique),!
composé! de! 89!%! de! cuivre,! 5!%! d’aluminium,! 5!%! de! zinc! et! 1!%! d’étain!en! masse.! Elle! a! un!
diamètre!de!19,75!mm,!une!épaisseur!de!1,93!mm!et!une!masse!de!4,10!g.!!
!
Document Wikipédia
Les!acides!sont!connus!depuis!l'Antiquité!pour!leur!pouvoir!dissolvant!auprès!des!métaux,!ainsi!
que,!il!est!vrai!de!manière!bien!plus!floue!avant!la!chimie!lavoisienne,!le!pouvoir!de!neutraliser!
les!solutions!alcalines.!Le!chimiste!britannique!Robert%Boyle!les!identifiait!au!XVIIème!siècle,!par!
leur! capacité! à! rougir! la! teinture! de! tournesol,! mais! aussi! par! leur! surprenant! pouvoir! de!
précipiter!le!soufre!de!ses!solutions!alcalines.!
!
Une!des!principales!propriétés!des!solutions!acides!est!de!pouvoir!dissoudre!un!grand!nombre!
de! matériaux.! Le! pouvoir! de! dissolution! dépend! de! la! concentration! de! l’acide! et! de! la! nature!
chimique!du!matériau!et!de!l’acide.!
Les& métaux,! quand! le! potentiel! standard! E°! du! couple! cation/métal! dérivant! de! ce! métal! est!
inférieur! à! 0,! ne!sont!pas! stables!dans! les!solutions! acides,! ils& sont& donc& oxydés!(c’est-à-dire!
ionisés! par! perte! d’un! ou! plusieurs! électrons)!;! l’ion! métallique! peut! alors! rester! sous! forme!
dissoute!(solvatée),!ou!se!combiner!avec!un!ou!plusieurs!ions!de!l’oxygène!et!former!un!oxyde.!
L’acidité!est!un!des!paramètres!importants!de!la!corrosion.!La!dissolution!des!métaux!est!utilisée!
en!gravure!d’art,!c’est!la!technique!de!l’eau!forte!;!!
Les!acides&concentrés&peuvent&provoquer&des&brûlures&sur&la&peau!et!les!muqueuses!(yeux,!
nez,!bouche).!L’utilisation!d’acides!concentrés!doit!toujours!se!faire!par!des!personnes!formées!
et!équipées!(blouse,!gants,!lunette).!
!
Les!acides!forts!du!laboratoire!sont!l’acide!sulfurique& H2SO4,!l’acide!nitrique& HNO3!et! l’acide!
chlorhydrique&HCl.!Ceux-ci!sont!totalement!dissociés!en!solution!aqueuse.!
!
Action de l’acide nitrique sur les métaux
L’acide! nitrique! réagit! différemment! des! autres! acides! forts! (HCl,! H2SO4)! sur! les!métaux!en!
raison!des!propriétés&oxydantes&de&l’anion&nitrate&NO3-.!Ainsi,!HNO3!réagissant!sur!un!métal!
ne! donne! jamais! de! dégagement! de! dihydrogène! H2,! contrairement! à! la! plupart! des! autres!
acides.!!
Les!métaux!tels!que!le!nickel,!le!cobalt,!le!cuivre,!le!mercure,!l'argent,!le!plomb,!le!sélénium,!le!

bismuth,!le!zinc!et!le!cadmium!se!dissolvent!dans!l'acide!nitrique.!D'autres!métaux!forment!un!
film!de!passivation!(film!protecteur).!Les!alliages!à!base!de!fer!se!dissolvent!mieux!dans!l'acide!
dilué.! Comme! il! réagit! avec! la! plupart! des!métaux! (sauf! l'or,! l'iridium!et! le!platine),! il! est! très!
utilisé!en!métallurgie!et!en!microélectronique.!!
!
Action de l’acide sulfurique sur les métaux
L'acide! sulfurique! attaque! les! principaux! métaux! usuels! en! donnant! un! sulfate! métallique! par!
libération! d'hydrogène.! L'acide! dilué! attaque! le! fer,! l’aluminium,! le! zinc,! le! manganèse! et! le!
nickel,!mais!seul!l'acide!concentré!et!chaud!peut!attaquer!l'étain!et!le!cuivre,!tandis!que!le!plomb!
et!le!tungstène!ne!sont!pas!attaqués.!
!
Action de l’acide chlorhydrique sur les métaux
Les!solutions!d'acide!chlorhydrique!concentrées!peuvent!dissoudre!certains!métaux!en!formant!
des!chlorures!d'oxydes!métalliques!et!du!dihydrogène!gazeux.!
!
Formation du monoxyde d’azote NO(g)
Le!monoxyde!d'azote!peut!être!synthétisé!au!laboratoire!selon!les!réactions!d'oxydoréduction!
suivantes,! où! un! dérivé! azoté! de! degré! d'oxydation! supérieur! à! +II! (acide! nitrique!:! +V!;! acide!
nitreux!:! +! III)! est! traité! par! le! réducteur! adéquat.! Toutes! ces! réactions! doivent! être! mises! en!
œuvre!en!l'absence!d'oxygène,!car!celui-ci!oxyde!rapidement!NO!en!dioxyde!d'azote,!NO2,!qui!est!
un! gaz! roux.! La! réaction! de! l’acide! nitrique! HNO3!par! certains! métaux! comme! le! cuivre!
conduisent!à!la!formation!de!NO.!
!
Les!solutions!d’ions!cuivre!(II)!sont!des!solutions!de!couleur!bleue.!Les!solutions!au!laboratoire!
sont!préparées!à!partir!de!cristaux!de!sulfate!de!cuivre(II),!pentahydratés.!
!
Travail&&à&réaliser&&
!
!
! Etablir! un! protocole! détaillé! qui! permette! de! déterminer! la! teneur! en! cuivre!
d’une!pièce!de!10!centimes!d’euros.!!
!
! Consulter!les!fiches!de!sécurité!des!produits!utilisés.!
&
! Mettre!en!œuvre!ce!protocole.!
&
! Justifier!la!valeur!du!volume!de!solution!d’acide!sulfurique!utilisé,!soit!30!mL.!
&
! Les! résultats! des! différents! groupes! seront! compilés! de! façon! à! effectuer! un!
calcul!d’incertitude!de!type!A.!
&
! Regardez! dans! votre! porte-monnaie! le! nombre! de! pièces! de! 10! centimes! que!
vous!possédez.!Evaluer!la!masse!de!cuivre!circulant!en!France!sous!la!forme!de!
pièces!de!10!centimes.!
&
!
Verrerie! courante! du! laboratoire,! produits! communs! du! laboratoire! de! chimie,! Handbook,! sont! à! votre!
disposition…comme!Anne-Françoise!et!moi.!☺!
1
/
2
100%