La liaison Carbone-Halogène

Organomagnésiens mixtes page 1/5
Les Organomagnésiens Mixtes
Le chimiste français Grignard synthétisa en 1901 le premier composé organomagnésien en faisant réagir l'iodure
d'isobutyle et le magnésium dans l'éther ordinaire anhydre ou éthoxyéthane (EtOEt = Et2O = H3CH2COCH2CH3)
Cette découverte lui valut le prix Nobel de chimie en 1912 conjointement avec P. Sabatier.
Le composé obtenu fait partie des composés organométalliques où l'on rencontre une liaison carbone-métal
C-M dans lesquels la polarité est très intéressante : C- M+, du fait de la plus grande électronégativité du
carbone que celle du métal.
Métal M
K
Na
Li
Mg
Al
Zn
Cd
Pb
Hg
Cu
Electronégativité (rappel (C) = 2,5)
0,82
0,93
0,98
1,31
1,61
1,65
1,69
1,87
2,00
2,5
% Caractère ionique de la liaison C-M
51
47
43
35
22
18
15
12
9
0
Ce sont des composés générateurs de carbanions. Exemple : R-Li (équivalent à) R⊖+ Li⊕
Quelques exemples d'organométalliques et nomenclature :
Formule
C2H5MgCl
PhLi
(CH3)2Cd
(CH3)2CuLi
Nom
chlorure d'éthylmagnésium
Phényllithium
diméthylcadmium
diméthylcuprate de lithium
C-Na (organosodé); C-Li (organolithien); C-K (organopotassé); C-Al (organoaluminé)
C-Mg (organomagnésien); ...
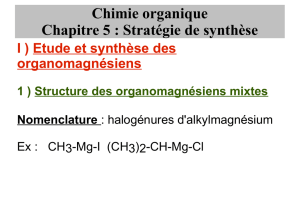
La leçon s'intéresse particulièrement aux composés à base de magnésium, et, puisque ce métal est divalent, aux
organomagnésiens mixtes ou réactif de Grignard (prix Nobel 1912 pour leur synthèse) :
Organomagnésiens mixtes :R-Mg-X (où X est un halogène et R un groupe alkyl)
Nomenclature: RMgX:halogénure d'alkylmagnésium
CH3CH2MgBr bromure d'éthylmagnésium , MgI: iodure de phénylmagnésium
I Réactivité des organomagnésiens mixtes
Ces composés RMgX sont polaires : R-Mg+X et la liaison carbone magnésium peut se casser pour
libérer le carbanion R⊖.
1 Propriétés basiques
R⊖ est une base très forte et pourra capturer tout hydrogène mobile (acide) d'autres composés A-H pour
donner l'alcane RH correspondant et la base associée à AH :
R⊖+ A-H R-H + A⊖ ou encore RMgX + A-H RH + AMgX

Organomagnésiens mixtes page 2/5
Exemples :
RMgX + H2O RH + HO⊖+ Mg2+ + X⊖ : réaction totale qui génère OH⊖(RMgX est une base plus forte
que OH⊖)
Note : ici les ions obtenus peuvent s'écrire: HO⊖+ Mg2+ + X⊖ ½ MgX2 + ½ Mg(OH)2 (précipité)
RMgX + R'OH RH + R'O⊖+ Mg2+ + X⊖; (RO⊖: base très forte, moins que R⊖)
RMgX + R'CC-H RH + R'CC-MgX (réaction de synthèse d'organomagnésiens acétyléniques)
Et des réaction similaires avec: NH3, RNH2(amines), RCONH2(amides), RCOOH (acides carboxyliques)...
2 Propriétés nucléophiles
R⊖ est aussi un très bon nucléophile qui pourra donner des substitutions nucléophiles sur des liaisons simples
polarisées (comme RX par exemple), et des additions nucléophiles (et non électrophiles) sur des doubles
liaisons fortement polarisées (exemple classique: C=O, mais pas sur les alcènes trop peu polarisés).
II Préparation des organomagnésiens mixtes
Elle se fait à partir de l'halogénoalcane correspondant et de
magnésium métal dans un solvant rigoureusement sec et
aprotique: éther anhydre, tétrahydrofuranne (THF) anhydre.
Le bilan est : RX + Mg RMgX
On peut aider l'amorçage de la réaction grâce à un bain d'eau
légèrement chaude (60 à 80°C), que l'on ôtera lorsque la
réaction a démarré, car elle est exothermique.
Il pourra être nécessaire de la ralentir avec un bain d'eau froide.
1 Les réactions parasites
Toute trace d'eau (venant de l'atmosphère, du solvant imparfaitement anhydre ou protique, de la verrerie, du
magnésium, de RX...) empêcherait la formation du magnésien: RMgX + H2O RH + HO⊖+ Mg2+ + X⊖
Cette réaction est totale et est le principal ennemi de cette synthèse.
a) On devra, avant de la faire, mettre la verrerie et le magnésium à l'étuve (120°C).
b) L'éther doit être distillé à l'avance et conservé sur sodium ou sur tamis moléculaire
(petites billes poreuses piégeant l'eau).
c) On veillera à isoler le réacteur de l'air atmosphérique humide tout en laissant une
ouverture sur l'extérieur car l'éther est très volatil. La température du milieu lorsque la
réaction a démarré étant supérieure à sa température d'ébullition : 32°C), l'éther doit
pouvoir s'échapper. On dispose de deux méthodes : au laboratoire, on peut faire passer un
courant gazeux d'azote sec qui empêche l'air de pénétrer. Cette méthode est chère (il faut
une bouteille d'azote), on pourra aussi utiliser une garde contenant du chlorure de calcium
CaCl2(bon desséchant, voir figure).
Le magnésien pourrait également réagir avec les gaz présentes dans l'air: O2et CO2.
RMgX + O2 ROO⊖ + Mg2+ + X⊖ (ROO⊖= anion peroxyde),
RMgX + CO2 RCOO⊖ + Mg2+ + X⊖ (RCOO⊖= ion carboxylate)
La méthode du courant d'azote gazeux élimine ces deux réactions, elle est la meilleure.
Enfin, le magnésien, excellent nucléophile, pourra se substituer à X sur l'halogénure de départ par la réaction
de duplication de Wurtz (vue plus loin dans la leçon): RMgX + RX R-R + Mg2+ + 2 X⊖
Il sera nécessaire d'avoir toujours un excès de magnésium par rapport à RX, afin que RX réagisse avec celui ci
plutôt qu'avec lui-même. On ajoute donc RX goutte à goutte pour qu'il soit en concentration faible, ce qui a
l'avantage supplémentaire de rendre la réaction (exothermique) plus contrôlable.

Organomagnésiens mixtes page 3/5
2 Influence des réactifs et du solvant dans la synthèse de RMgX
Nous avons déjà vu que le solvant ne doit pas avoir de H mobile (pas d'eau par exemple).
On utilise souvent des étheroxydes comme C2H5OC2H5 (diéthyléther: éther des pharmaciens), où le
tétrahydrofuranne THF (éther cyclique à quatre carbones, meilleur solvant que le précédent car les doublets de
l'oxygène sont moins encombrés).
On peut aussi utiliser des amines tertiaires (mais pas primaires ou secondaires qui possèdent un ou plusieurs H
mobiles).
Le solvant aide à la cassure de la liaison
C-X, et solvate l'organomagnésien final.
Voici une des structures du magnésien
solvaté par l'éther :
La réactivité de RX augmente avec la
masse de l'halogène: Cl < Br < I (liaison C-X plus polarisable)
La réactivité de RX diminue avec la classe de R : I > II > III > Br (effet d'encombrement stérique, et pour
Br il y a perte de la résonance de avec le doublet de X).
On peut aussi préparer de cette façon des organomagnésiens vinyliques CH2=CH-Mg-Br à partir de
CH2=CHBr, et acétylèniques HCC-Mg-Br à partir de HCCBr. On choisir un bon solvant (THF) car la
cassure de la liaison C-Br est plus difficile (perte de résonance du doublet de X avec = ou ).
III Propriétés nucléophiles des organomagnésiens mixtes
1 Substitution nucléophiles
Réaction de Wurtz:
Cette réaction qui a déjà été citée comme une
réaction parasite de la synthèse de RMgX, peut
servir à allonger une chaîne carbonée.
On l'appelle alors synthèse de Wurtz. On obtient ainsi facilement une SN1avec les systèmes résonnants :
RMgX + CH2X CH2R + MgX2 ; RMgX + CH2=CH-CH2X CH2=CH-CH2R + MgX2
Action sur les époxydes:
La première étape (dans
l’éther) est une SN2 (mais
le bilan est en fait une
addition).
On obtient un halogénure
d'alcoolate magnésium
RCH2CH2OMgX (analogue d'un alcoolate: RCH2CH2O⊖ + Mg2+ X⊖ et donc très basique).
Par hydrolyse acide (deuxième réaction), on obtient l'alcool et Mg2+ 2 X⊖(MgX2est soluble en milieu
acide).
Dans le cas d'un époxyde dissymétrique, R⊖ attaque le carbone le moins encombré (si le contrôle est
cinétique).
Action sur les dihalogènes :
RMgX + I-I RI + ½ MgI2+ ½ MgX2
Cette réaction est intéressante quand il est difficile d'obtenir RI par substitution nucléophile directe :
RX + I⊖ RI + X⊖ (R encombré par exemple).
On préfère alors la séquence RX RMgX RI
CH3CH CH2
O
R Mg X
+ +
a
a
b
bCH3CH CH2
R
OMgBr
+CH3CH CH2
OMgBr
R
mélange
b
a: majoritaire
CH3CH CH2
O
R
MgBr
+CH3CH CH2R
OH
O
HH
H
+ H2O + Mg + Br
2
++
RX
Mg OEt
Et
O
Et
Et
OEt
Et
OEt
Et
R
X
Mg
2
organomagnésien solvaté par l'éther
Mg XX
+R R'
+
+R' X
+R Mg X

Organomagnésiens mixtes page 4/5
2 Additions nucléophiles
Ces additions ne se font que sur des liaisons multiples (C=O, CN) polarisées (pas sur C=C ni CC)
a) Sur la double liaison C=O
) fonction carbonyle: les aldéhydes et cétones sont très polarisées et réactives :
Le bilan est donc :
On obtient :
* un alcool primaire en partant du méthanal,
* secondaire en partant d'un aldéhyde,
* et tertiaire en partant d'une cétone.
) dérivés carbonylés:
On appelle dérivés carbonylés les compsés suivants, issus de la fonction carboxylique :
Les acides carboxyliques et amides RCONH2 ne sont pas dans cette liste car ils possèdent un ou plusieurs
hydrogènes mobiles.
Dans tous les cas le groupement Z est attracteur.
Toujours dans l'éther anhydre, on aura le mécanisme simplifié :
Le composé intermédiaire (similaire à un alcoolate) est rendu instable par la présence de deux groupements
attracteurs.
Il évolue vers une cétone (ou un aldéhyde) qui elle même va réagir sur RMgX pour donner l'alcool
correspondant. Le bilan sera donc après hydrolyse en milieu acide :
+
+
R Mg X
C O
R1
R2+ C O
R1
R2
R
MgX
halogénure d'alcoolate magnésium
C O
R1
R2
R
MgX +OHH C O
R1
R2
R
H + MgXOH
(1/2 MgX2 + 1/2 Mg(OH)2)
C O
R1
R2
R
H + Mg + X + H2O
2
H
C O
R1
R2
R
HC O
R1
R2
R Mg X +1) éther anhydre
2) H2O, H+
2
+ Mg + X + H2O
CO
R1OR2
ester chlorure d'acyle
CO
R1X
anhydride d'acide
CO
R1O
R1O
C
CO
R1Z
formulation générale
+
+
CO
R1Z
R Mg X+C O
R1
R
MgX
Z
+
C O
R1
R
+ Z-MgX
+
R Mg XCO
R1Z2) H2O, 2 H+
1) éther anhydre
2C OH
R
R
R1
+ 2 Mg + 2 X + ZH + H2O
2

Organomagnésiens mixtes page 5/5
) dioxyde de carbone
L’action du CO2 (sous forme de carboglace par
exemple) conduit à la formation d’un acide carboxylique
ayant un carbone de plus.
On retiendra la suite des étapes :
RX
Mg
CO2
H O H
2,
RCOOH
b) Sur la triple liaison CN
La liaison CN est très polarisée, et réagit bien sur les magnésiens
On obtient après hydrolyse, une imine qui, instable en milieu acide, évolue vers une cétone.
C’est une voie de synthèse des cétones avec un excellent rendement.
Le bilan complet est : R1MgX + RCN + 2 H+ + H2O R1RC=O + NH4+ + Mg2+ + X⊖
C NR
++R1Mg X+
H2O, H+
CN
RMgX
R1CN
R
R1
H
+ Mg + X
imine
CN
R
R1
H
H+
H2OCN
RH
O
R1
H H
HCN
RH
OH
R1H
H
C
RO
R1
H+ NH3C
RO
R1+ NH4
+
R Mg X+
+
C OO CO
ROMgX
CO
RO MgX + H+
+
CO
RO H
+ Mg + X
2
1
/
5
100%