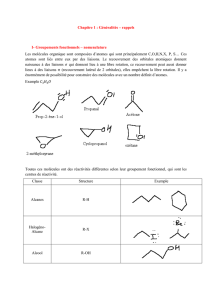
2016-01-18 UE23 2016 chap1 OAOM

1 1
Licence Physique/Chimie
UE 23b
Introduction à la Chimie Organique
CM : 16 h TD : 20 h

2 2
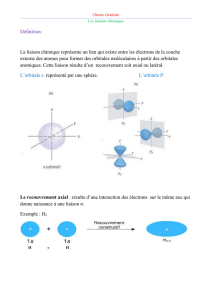
La Liaison Chimique
Orbitale atomique et orbitale moléculaire
Rappels

3 3
I. Introduction
• Un atome est constitué : - d’un noyau [proton(s) Z + neutron(s) = nucléons A]
- et d
’
électron(s) e
-
• Les e- : charge élémentaire négative q = -1.6 10-19 C
• Les protons : charge élémentaire positive q = 1.6 10-19 C
• Les neutrons sont neutres
m e- (9.1 10-31 kg) négligeable devant celles des protons
(1.6726 10-27 kg) et celles des neutrons (1.6749 10-27 kg)
Masse de l’atome est concentrée dans le noyau
X
A
Z
Numéro atomique
Nb. de protons
Nombre de masse
Nb. de nucléons
Étude des électrons : leur nombre et leur arrangement déterminent la façon dont un atome réagit
avec d
’
autres pour former des molécules

4 4
Le modèle atomique de Bohr-Sommerfeld basé sur la mécanique classique a connu plusieurs
limites notamment avec l’apparition dans les années 1920 de la théorie de la mécanique quantique
développée indépendamment par Heisenberg, Schrödinger et Dirac.
Ø dualité onde / particule (De Broglie, 1923): à l’électron de masse m doit être
associé une onde de longueur d’onde λ = h/mv; v étant la vitesse de l’électron et h la
constante de Planck.
1. Modèle quantique (ou ondulatoire) de l
’
atome
Dans cette théorie le modèle de l’atome est fondé sur deux principes :
Ø le principe d’incertitude d’Heisenberg (1927) : il n’est pas possible de
déterminer simultanément la position précise d’un e- et sa quantité de mouvement
(donc son énergie).
II. Orbitale atomiques pures (organisation des e
-
dans l
’
atome)

5 5
Ces OA peuvent - prendre des formes différentes
- correspondent à des niveaux d’énergie différents
sont décrites par 3 nombres quantiques Ψn,l,m
Dans cette théorie, l’expression mathématique qui décrit le mouvement d’1 e- est
appelée équation de Schrödinger (HΨ = EΨ) et apparaît sous forme d’équations
(équations d’ondes) très semblables aux équations caractéristiques des ondes.
Les solutions de ces équations (fonctions d’onde ou orbitales atomiques)
n’existent que pour des valeurs quantifiées de l’énergie.
Seul le carré de la fonction d’onde (dP/dV= Ψ2) a une signification physique :
exprime la probabilité de présence de l’électron dans une certaine région de
l’espace.
OA = région de l
’
espace autour du noyau atomique où la probabilité de trouver un e
-
est de
90%
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%