Médecine nucléaire 2013: The «New Clear Medicine

1065
HIGHLIGHTS 2013: MÉDECINE NUCLÉAIRE
Médecine nucléaire 2013: The «New Clear Medicine»
Irene A. Burger
Klinik für Nuklearmedizin, UniversitätsSpital Zürich
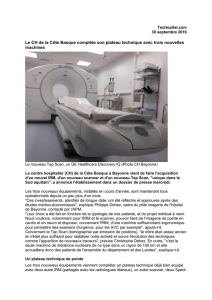
TEP/IRM – obstacles techniques
Le principe de «trimodalité»
x
Forum Med Suisse 2013;13(51–52):1065–1066

HIGHLIGHTS 2013: MÉDECINE NUCLÉAIRE
Forum Med Suisse 2013;13(51–52):1065–1066 1066
x
Perspectives
Correspondance:
Dr Irene A. Burger
Klinik für Nuklearmedizin, UniversitätsSpital Zürich
Rämistrasse 100
CH-8091 Zürich
Irene.Burger[at]usz.ch
Références
Figure 1
A
B
AB
Figure 2
(A)
(B)
(C)(D)
AB
CD
1
/
2
100%