25/09/2014 CR: BRASSIER Julia. TEHHANI Anissa L2

TSSIBS – Différenciation et fonctions immunitaires des cellules myéloïdes
25/09/2014 CR: BRASSIER Julia.
TEHHANI Anissa L2
TSSIBS
Pierre BONGRAND
8 pages
Différenciation et fonctions immunitaires des cellules myéloïdes
Pour approfondir ses connaissance :
–Cour d'immunobiologie de Janeway
–Bach & Chatenoud
L'examen se constitue de 20 QCM
Introduction
Le système immunitaire joue un rôle important dans la plupart des pathologies :
–les infections (l'homme est un milieu de culture pour les agents infectieux notamment les bactéries) le
problème des individus complexes était de développer un système difficile à contourner par les agents
infectieux,
–la maladie cardiovasculaire : le système immunitaire joue un rôle important comme dans
l'athérosclérose qui est une maladie inflammatoire, les déchet sur les parois des vaisseaux attirent les
cellules de l'immunité, les cellules de l'immunité doivent les éliminer seulement ce travail peut être mal
fait,
–les allergies, on assiste à une augmentation de l'incidence allergique elles sont très liées à
l'environnement (exemple de la réunification de Allemagne des procédés sont devenues communs entre
les deux Allemagnes et on a vu apparaître une augmentation des allergies des deux côtés) ,
–les maladies auto-immunes (plus rares comme maladies comme le diabète insulinodépendant, le
système immunitaire détruit le pancréas et donc l'insuline),
–les transplantations (thérapeutique efficace et est essentielle, problème de compatibilité),
–les biomatériaux (cathéter, prothèses dentaires, prothèses articulaires, deux problèmes à éviter :
infection ou inflammation stérile qui provoque une ostéolyse autour de la prothèse par exemple),
1/8
Plan
Introduction
A. Définition, description et cinétique
I. Définition et caractérisation
II. Distribution tissulaire et maturation
III. Activation des phagocytes mononucléés
B. Les fonctions des cellules myéloides
I. Migration (interaction avec l'endothélium, chimiotactisme)
II. Phagocytose
III. Présentation de l'antigène
IV. Libération de facteurs biologiquement actifs
V. Cytotoxicité
VI. Phagocytes mononucléés et athérosclérose
VII. Fonction ostéoclastique

TSSIBS – Différenciation et fonctions immunitaires des cellules myéloïdes
–les cancers, cellules tumorales peuvent être considérées comme des cellules étrangères, on pense à
l'immunostimulation pour les supprimer => encore au stade de recherche, le concept de
l'immunosurveillance des cancers, ils sont plus fréquents chez les transplantés mais pas de manière
significative, cela n'empêche pas que l'immunothérapie puisse être utilisée.
Dans tous les domaines de la pathologie, il y a une nécessité de comprendre le système immunitaire.
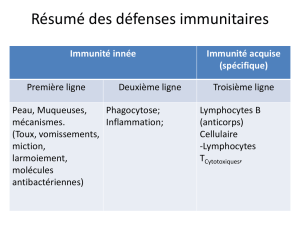
Le système immunitaire repose sur deux grands mécanismes :
–l'immunité innée
–l'immunité adaptative
Historiquement on s'est d'abord intéressé à l'immunité spécifique qui était plus fascinante pour l'Homme, le
système immunitaire apprend à reconnaître spécifiquement un agent étranger et l'élimine.
On s'est aperçu que l'immunité spécifique ne suffisait pas, il y a aussi l'immunité innée. Si on avait pas de
mécanismes qui permettent de barrer la route très vite l'immunité spécifique n'aurait pas le temps de réagir, il
faut un dialogue entre l'immunité innée et spécifique. Dans l'immunité spécifique il faut reconnaître ce qui est
dangereux, il ne peut pas se mettre en marche tout de suite à chaque intrusion il faut qu'il y ait des signaux pour
dire au système spécifique que cela vaut la peine de se déclencher. Le système innée élimine vite et alerte le
système spécifique.
Comment identifier une infection ?
–les agents infectieux sont souvent des bactéries qui ont des structures propres donc reconnaissables, les
cellules de l'immunité peuvent reconnaître ces structures reconnaissables
–s'il n'y avait que ça il y aurait eu adaptation de la part des agents infectieux et ils nous ressembleraient
pour ne pas être éliminés de notre organisme, le deuxième mécanisme consiste à reconnaître des cellules
endommagées, et à envoyer des signaux.
Les cellules myéloïdes sont impliquées dans les deux mécanismes.
A. Définition, description et cinétique
Comment donner une définition une population cellulaire ?
I. Généralité - Histoire
Historiquement le système réticulo-endothéliale a été identifier par Ashoff. Dans les année 70 on a défini le
système des phagocytes mononuclées.
Trois populations à distinguer :
–les polynucléaires : aspect morphologique = noyau multinucléé, on les appelle granulocytes car il ont
des granulations particulières. Ils ont une fonction essentielle qui est la phagocytose : élimination des
agents infectieux
–les phagocytes mononuclées : population de cellule phagocytaire avec un noyau différent des
granulocytes, ces cellules les phagocytes mononuclées ont plein de fonctions et vivent plus longtemps et
doivent être activées pour phagocyter, les polynucléaires neutrophiles sont plus efficaces pour éliminer
les agents infectieux car ils sont toujours prêts
–les cellules dendritiques : de découverte plus récente elles sont largement associées aux phagocytes
mononuclées, elles stimulent la réponse spécifique.
La plasticité des différentes populations rend difficile la distinction des types cellulaires, il vaut mieux
représenter un réseau qu'un arbre pour catégoriser les cellules, dire qu'il existe des populations cellulaires est
une approximation.
2/8

TSSIBS – Différenciation et fonctions immunitaires des cellules myéloïdes
Comment définir une population cellulaire ?
Morphologie : examen morphologique à la base de la définition.
Cytochimie : mettre en évidence des enzymes particuliers dans les différents
types cellulaires.
Fonctions : phagocytose=> cellules phagocytaires, adhésion, présentation,
Marqueur antigénique : technique d'identification des marqueurs
immunologiques reconnus par des Anticorps avec cytométrie de flux.
Le transcriptome : mettre en évidence l'activation de tout les gènes, moyen
d'étudier le population cellulaire. Actuellement stade où la biologie a trop
de données et ne sait pas quoi en faire.
La cytométrie de flux : outil accessible en routine
=> principe on prend des cellules du sang on les analyse une par une, on crée un écoulement liquide de très
faible dimension, les cellules passent une par une au travers du faisceau du laser et chaque fois qu'elles passent
on les analyse.
On mesure la diffusion de la lumière (détournement de la lumière) : une partie de la lumière va être transformée
en une lumière de longueur d'onde différente (fluorescence) grâce à cela on peut étudier des molécules seules.
Classiquement le principe de base c'est une fois que les cellules sont passées on les marque avec des anticorps
fluorescents et chaque fois qu'une cellule passe on regarde la diffusion de la lumière qui permet de différencier
des cellules. Plus la cellule est grosse plus elle diffuse, et quand une cellule contient plein de granule elle
diffuse plus car il y a beaucoup de changement d'indice de réfraction, donc on mesure les petits angles de
réfraction pour la taille et les grands angles pour les granulations.
Les anticorps monoclonaux sont des outils très importants : en immunologie principe de la théorie clonale,
les lymphocytes fabriquent des anticorps, est ce qu' un lymphocytes peut fabriquer un ou plusieurs anticorps ?
Un lymphocyte fabrique un seul type d'anticorps, il faut donc des millions de cellules immunitaires, cette
spécificité paraissait paradoxale, si un individu reconnaît la bactérie il y a plusieurs anticorps différents qui
reconnaissent différentes parties de la bactérie qui sont produites par cet individu. Cela a rendu les anticorps
difficile à utiliser.
3/8

TSSIBS – Différenciation et fonctions immunitaires des cellules myéloïdes
On a comparé les résultats des différents laboratoires, tester les cellules pour voir quels anticorps elles
reconnaissaient, il y a des familles d'anticorps qui reconnaissent toutes la même chose, les clusters de
différenciation (CD) donc des antigènes de surface des leucocytes, à quoi ils servent ?
LFA1 : molécules d'adhésion, le premier antigène dont on sait à quoi il sert.
Les anticorps servent à caractériser des cellules :
–CD14 relativement spécifique des phagocytes avec fonction reconnaissance des lipopolysaccharides
(LPS) des bactéries (gram -)
–CD11/CD18 molécules d'adhésion leucocytaire de la famille des intégrines (deux chaînes α et β), les
intégrines β2 sont leucocytaires (β3 plutôt pour l'hématologie), ils ont au moins deux intégrines β2 dont
LFA1 qui est une molécule d'adhésion leucocytaire et surtout lymphocytaire, MAC1/CR3 (macrophage
1) les anticorps monoclonaux servent à reconnaître les populations cellulaires MAC1 spécifiques des
macrophages c'est aussi une intégrine β2
–CD16, CD32, CD64, récepteur de immunoglobuline (monocyte) important pour la phagocytose.
L'analyse en composant principaux : procédé abstrait de traiter des données multidimensionnelles. (pas à
l'examen)
II. Distribution tissulaire et maturation
➢Les granulocytes sont essentiellement dans la sang donc vivent quelque jours et disparaissent, en cas
d'infection ils vont dans les tissus.
➢Les phagocytes mononuclées, ils sont sous forme de monocytes dans le sang puis passent dans les
tissus et peuvent y vivrent plusieurs mois, (cellule Kupffer dans le foie, ostéoclastes dans les os,
macrophage dans la cavité pleurale, péritonéal et péricardique...) ce sont des cellules ubiquitaires.
➢Les cellules dendritiques périphériques sont très phagocytaires et immatures (ex des cellules de
Langerhans), elles se mettent en mouvement après ingestion de l'agent puis se différencient et vont
rencontrer les lymphocytes (qui sont dans les ganglion). => c'est le cycle dendritique
Régulation de ce cycle avec des facteurs de croissances tel que MCSF, GCSF, GMCSF, MultiCSF:IL3.
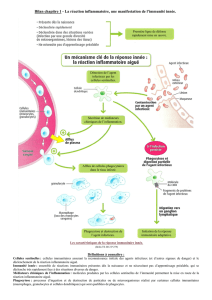
III. Activation des Phagocytes mononuclées
Ce sont des cellules de grande plasticité (difficile a étudier), un macrophage est au repos dans les tissus, pas très
utile, c'est un phagocyte avec de grandes capacités, avec plusieurs fonctions mais ne les fait pas toutes en
même temps et il faut l'activer !
Sur les infections, il existe des germes/bactérie à développement intracellulaire se développent très vite et vont
dans les phagocytes car ce sont des cellules qui vivent longtemps (ex de bactérie le BK pour bacille de Koch
responsable de la tuberculose), la digestion dépend de l'activation du macrophage qui est donc essentielle. Un
macrophage résident (dans les tissus) est endormi, pour le réveiller complètement et qu'il soit capable de digérer
complètement le germe il faut les interferons γ.
Plus récemment à partir de ce concept est venue cette notion :
un macrophage qui s'active peut s'activer selon deux voies différentes (adaptation au type d'infection)
–voie M1 agent à développement intracellulaire la capacité de digestion est augmentée (comme le BK)
–voie M2 pour les agents à développement extracellulaire qui se baladent dans les liquides biologiques,
la capacité de phagocytose est augmentée.
4/8

TSSIBS – Différenciation et fonctions immunitaires des cellules myéloïdes
La réponse immunitaire des macrophages s'adapte au type d'agent infectieux, on peut aussi distinguer la
réponse cellulaire et humorale pour les lymphocytes.
On s'est dit qu'il y avait trois voies, les macrophages ont plusieurs fonctions donc trois voies d'activation
différentes :
–voie effectrice (M1 ou M2) développement de capacité d'élimination d'agent infectieux (destruction)
–voie de réparation, on élimine tout puis on doit réparer les tissus, il doit pour cela inhiber la réponse
immunitaire et stimuler les fibroblastes grâce à des messages (ex des ostéoplastes)
–présentation aux lymphocytes des antigènes
Si le macrophage est trop actif il détruit l'antigène en digérant les germes, donc pas de réponse possible et s'il
n'est pas assez actif, il n'y pas de réponse non plus.
Pour être activé, et pour la reconnaissance d'agents infectieux un macrophage a des récepteurs qui lui permet de
reconnaître une infection :
•soit parce que des molécules sont libérées par les cellules endommagées (MAF/ interféron γ)
•des récepteurs TLR qui reconnaissent les agents infectieux (l'ARN à deux brins des agents)
•aussi les scavenger receptor ou récepteurs éboueurs qui jouent un rôle dans l'athérosclérose en
reconnaissant les lipides dénaturés.
B. Les fonctions des cellules myéloïdes
I. Migration des leucocytes
Les cellules immunitaires patrouillent en permanence, les cellules dans le sang vont s'arrêter dans les vaisseaux
et les traverser pour agir.
=> interaction avec l'endothélium
Étape essentielle de la réaction inflammatoire, accrochage des cellules immunitaires aux parois des vaisseaux
grâce à des molécules d'adhésion.
Famille de molécule d'adhésion :
–découvertent tardivement, les sélectines (les plus simples) permettent l'accrochage, aux parois des
vaisseaux, des leucocytes qui passent à toute vitesse. Ainsi appelées car leurs extrémités porte un
groupement lectine (molécule qui fixe des sucres), trois types de sélectines :
•P-selectine dans les plaquettes et les cellules endothéliales
•L-selectine sur les leucocytes
•E-selectine sur les cellules endothéliales
Ils peuvent s'accrocher car les cellules endothéliales stimulées se mettent à exprimer des sélectines (soit
E soit P). Les selectines accrochent les leucocyte par les mucines (ligand, écouvillon=grande tige
peptidique avec sucre) : PSGL1) ;
–les intégrines, intégrées dans la membrane, intégrine β1 interaction avec la matrice extracellulaire
(laminine), α4 β1 reconnaît aussi les CAM ;
–les molécules de la superfamille des immunoglobulines, les CAM. Les protéines sont faites d'un
certain nombre de domaine (= structure remarquable trouvée dans des protéines qui ont une certaine
fonction et une certaine autonomie et une stabilité), faire un domaine est complexe si on prend 100 AA
ont n'aura pas de protéine, au cours de l'évolution il y a apparition des domaines dans les protéines. Le
domaine Ig est retrouvé dans des molécules d'adhésion dont ICAM (molécule ubiquitaire) qui lie
l'intégrine LFA.
5/8
 6
6
 7
7
 8
8
1
/
8
100%