Éditorial

Éditorial
Chers Actionnaires,
En 2015, Celyad a jeté les bases qui lui permet-
tront de soutenir sa croissance en 2016 et
au-delà. À travers sa dernière acquisition
technologique et son introduction sur le
Nasdaq, Celyad est passée d’une entreprise
belge de thérapie cellulaire spécialisée dans
l’insuffisance cardiaque ischémique, à un
acteur international de premier plan ayant le
potentiel et les moyens de développer des
programmes cliniques dans les domaines
cardiovasculaire et immuno-oncologique en
Europe, aux États-Unis et en Asie.
Michel Lussier
— PRÉSIDENT DU CONSEIL D’ADMINISTRATION
Cette année sera très importante pour la
Société puisque les premiers résultats de notre
étude européenne de Phase III en cardiologie,
CHART-1, ainsi que les premiers résultats
de notre étude de Phase I/IIa en immuno-
oncologie (NKR-2) seront disponibles mi-2016.
Nous espérons que les résultats de Phase III
démontreront les bénéces cliniques attendus
par des millions de patients dont la qualité de
vie pourrait être considérablement améliorée.
Le potentiel de notre programme en
immuno-oncologie est également très impor-
tant et Celyad n’est qu’au début de l’aventure.
Nous avons de nombreuses opportunités à
exploiter avec des essais cliniques de thérapies
cellulaires autologues NKR-2 sur des tumeurs
liquides et solides et le développement de
notre plateforme allogénique, désormais
protégée par une très vaste et solide propriété
intellectuelle. Le brevet américain que nous
avons reçu présente un large champ d’appli-
cations potentielles dans le développement
de thérapies CAR-T TCR-décients. Cela peut
radicalement changer la dynamique du secteur
de l’immuno-oncologie et faire de Celyad un
leader incontournable quand viendra le temps
de la commercialisation.
Je prote de cette opportunité pour remercier
l’équipe de Celyad pour les eorts fournis, jour
après jour, pour proposer des traitements
innovants aux patients et faire de Celyad une
entreprise prospère. Je tiens également à vous
remercier pour le soutien et la conance que
vous accordez à notre Société.
Lettre aux actionnaires Mars 2016

JANVIER - Celyad s’engage dans
l’immuno-oncologie avec l’acquisition du
portefeuille CAR-T Oncyte développé
par Celdara Medical. Ce portefeuille
comprend trois produits de thérapies
cellulaires CAR-T autologues ainsi qu’une
plateforme allogénique visant un large
éventail d’indications cancéreuses.
MARS - 32 millions d’euros sont levés via
placement privé d’actions ordinaires auprès
d’investisseurs institutionnels spécialisés
en sciences de la vie aux États-Unis et en
Europe.
La Société reçoit une dérogation spécique
de produit pédiatrique pour C-Cure®
de la part de l’Agence Européenne du
Médicament.
AVRIL -Recrutement du premier patient de
l’essai clinique de phase I/IIa pour évaluer la
sécurité et la faisabilité des cellules T CAR-T
NKG2D chez les patients cancéreux avec
des indications hématologiques.
MAI - Cardio 3 BioSciences devient Celyad.
Évènements clés de 2015
JUIN - Celyad lève 100.1 millions de dollars
en revenu brut avec son introduction en
bourse sur le Nasdaq.
JUILLET - Traitement du dernier patient
CHART-1 (Congestive Heart failure
Cardiopoietic Regenerative Therapy
– thérapie réparatrice cardiopoïétique
de l’insuffisance cardiaque congestive)
participant à l’essai clinique européen de
Phase III et début de la période de suivi
de 9 mois. Les données complètes sont
attendues à la mi-2016.
AOÛT - Nouvel accord de collaboration et
de distribution avec Medisun International
Limited (« Medisun »), un partenaire basé à
Hong Kong. Le contrat de licence conrme
l’intention de Ceylad d’étendre l’empreinte
internationale de C-Cure®, son principal
produit candidat de thérapie cellulaire dans
le domaine des maladies cardiaques pour
le traitement de l’insusance cardiaque
ischémique.
NOVEMBRE - Octroi du brevet américain
n°9,181,527 pour les lymphocytes T
primaires humains allogéniques conçus
pour être TCR-décients (récepteur des
lymphocytes T) et exprimer un récepteur
antigénique chimérique (CAR).
Lettre aux actionnaires Mars 2016

TOUT AU LONG DE 2015
Renforcement du management avec le
recrutement de directeurs expérimentés
Initiation de la certication par l’EMA des
données non cliniques de C-Cure® visant
à préparer la demande d’autorisation de
mise sur le marché.
Celyad rebaptise son programme CAR
T-Cell et le nomme « NKR-T » pour Natural
Killer Receptor T-cells (CAR-T NKG2D
devenant NKR-2).
Fin du suivi de sécurité de 30 jours du
premier patient de la cohorte dans l’essai
de phase I/IIa NKR-2 démontrant l’absence
de réponse toxique de la première dose
jamais testée sur l’homme.
DÉCEMBRE - Traitement du premier
patient de la seconde cohorte dans l’essai
de phase I/IIa NKR-2.
Publication de l’article sur les méthodes
de conception de l’essai CHART-1 dans
le « European Journal of Heart Failure ».
La Food and Drug Administration
(FDA) américaine autorise la Société à
investiguer un nouveau médicament et
autorise l’utilisation du cathéter C-Cathez
TM
pour administrer C-Cure® dans l’essai
clinique CHART-2.
Lettre aux actionnaires Mars 2016

Immunothérapie - une nouvelle approche ciblée
pour lutter contre les cancers
L’immunothérapie pour le
traitement du cancer
L’immunothérapie se fonde sur le principe
que notre système immunitaire est capable
de détruire les cellules anormales telles que
les cellules cancéreuses. Toutefois, il arrive
que certaines de ces cellules développent des
mécanismes de protection qui leur permettent
d’échapper à la détection ou à l’activité de nos
défenses immunitaires. Les thérapies déve-
loppées en immuno-oncologie tentent donc de
rétablir et d’activer la capacité de notre système
immunitaire à détecter et détruire les cancers.
Lymphocytes T à récepteur antigénique
chimérique (CAR T-cells)
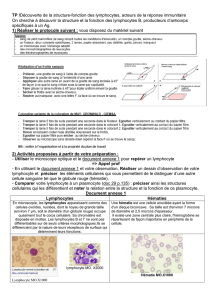
Le lymphocyte T est l’un des acteurs clés de
l’immunothérapie contre le cancer. Il s’agit
d’un globule blanc qui est doté de mécanismes
destructeurs de cellules (cytotoxicité). Chez les
sujets sains, les lymphocytes T identifient et
détruisent les cellules infectées ou anormales,
y compris les cellules cancéreuses.
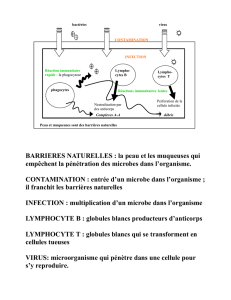
Un récepteur antigénique chimérique (CAR) naît
de la modification génétique d’un lymphocyte T.
On insère, dans l’ADN d’un lymphocyte T,
une séquence qui le poussera à exprimer
un anticorps (défense immunitaire) conçu
pour reconnaître et se lier à un antigène
(une protéine identifiée comme nocive par le
système immunitaire) présent sur la cellule
cancéreuse. L’antigène exprimé par la cellule
cancéreuse peut également être exprimé par
une cellule normale, il faut donc veiller à cibler
les bonnes cellules.
Une fois que l’anticorps est lié à l’antigène,
une autre protéine, qui aura été préalablement
ajoutée dans le lymphocyte T, déclenchera
la destruction des cellules cancéreuses. Ce
signalement intracellulaire est généralement
un fragment d’une protéine appelée CD3. Un
lymphocyte T qui combine à la fois l’anticorps
qui permet la reconnaissance de la cellule
cancéreuse et le signalement qui permet de
la détruire est un lymphocyte T à récepteur
antigénique chimérique (ou cellule CAR-T).
Afin de rendre les cellules CAR-T encore plus
puissantes, les chercheurs y ajoutent d’autres
protéines (des molécules co-stimulantes)
chargées de les aider à survivre plus longtemps
(et à se multiplier) une fois administrées dans
“Ces derniers temps, nous avons reçu beaucoup de ques -
tions de la part de nos actionnaires à propos de notre
plateforme en immuno-oncologie. Cette technologie est
complexe. C’est pourquoi nous avons décidé d’expliquer,
de manière plus vulgarisée, le potentiel de notre pro -
gramme NKR-T et plus particulièrement, des atouts qui
le rendent différent et unique.”
—DR. CHRISTIAN HOMSY, CEO.
Lettre aux actionnaires Mars 2016

l’organisme. Les molécules co-stimulantes les
plus utilisées sont appelées CD28 ou 4-1-BB.
L’anticorps (le récepteur donc), le domaine de
signalement intracellulaire et les molécules
co-stimulantes sont des protéines qui sont
fabriquées par le lymphocyte T lui-même, une
fois que les instructions permettant de les
coder ont été insérées dans le génome (ADN)
du lymphocyte T.
La technologie de fabrication
de CAR consiste à modifier les
lymphocytes T hors de l’organisme.
Les étapes sont les suivantes :
• Collecte des globules blancs du patient cancé-
reux à partir d’une prise de sang normale lors
d’un processus appelé leucaphérèse
• Sélection des lymphocytes T dans les globules
blancs
• Transfert des gènes codeurs pour le CAR dans
l’ADN des lymphocytes T et multiplication des
CAR pour obtenir une dose thérapeutique
• Réinjection de ces cellules chez le patient.
Cellules tueuses naturelles
et immunité innée
Les cellules tueuses naturelles (cellules NK
pour Natural Killer Cells) sont un autre type de
globules blancs. Elles constituent la première
ligne de défense contre les agressions exté-
rieures (virus ou bactéries) et contre le cancer.
Le rôle principal des cellules NK semble être la
surveillance, la détection précoce et la résis-
tance contre l’agresseur jusqu’au moment où les
lymphocytes B et d’autres cellules immunitaires
interviennent.
Contrairement aux lymphocytes B et T qui font
partie de l’immunité acquise, les cellules NK
font partie de l’immunité innée, c’est-à-dire
qu’elles ne doivent ni être activées par un facteur
extérieur, ni être exposées à une agression
(comme une infection par exemple) ayant créé
une mémoire immunitaire pour reconnaître
leur cible.
Les cellules NK utilisent des récepteurs (proté-
ines) naturellement présents à leur surface
pour identifier et se lier à ce que l’on appelle
des ligands qui sont des molécules spécifiques
exprimées par les cellules soumises à un stress.
Les cellules NK ont à la fois des récepteurs
activateurs (comme le NKG2D ou le NKp30) et
des récepteurs inhibiteurs.
Les cellules NK seront naturellement activées
si la balance entre les signaux activateurs et
les signaux inhibiteurs penche en faveur des
signaux activateurs. L’objectif physiologique
de cet équilibre est d’éviter que les cellules NK
attaquent des cellules saines de notre corps,
tout en les maintenant actives contre les cellules
stressées. Cet équilibre est également utilisé
par les cellules cancéreuses pour échapper
au système immunitaire. Certaines thérapies
expérimentales tentent donc d’interférer avec
les signaux inhibiteurs des cellules NK et d’en
libérer l’activité destructrice sans qu’elle soit
entravée par les signaux inhibiteurs.
Lettre aux actionnaires Mars 2016
 6
6
1
/
6
100%