Le noyau atomique

Le noyau atomique!
Composition, stabilité et…
désintégration !!

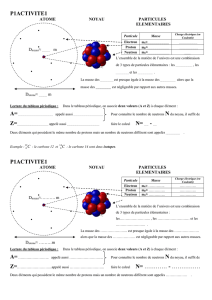
Composition de l’atome
Atome
Protons Quark u
Quark u
Quark d
Neutrons Quark u
Quark d
Quark d
Electrons
© 2016, MFr. Le noyau atomique 2

Structure du noyau!
Neutron!
Proton!


Les isotopes dʼun élément!
Ils possèdent le même
nombre de protons.!
Le nombre de neutrons
change.!
Les propriétés chimiques
des isotopes dʼun élément
sont identiques.!
Les propriétés physiques
des isotopes sont
différentes.!
Exemple : lʼhydrogène.!
Hydrogène!
Deutérium!
Tritium!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%