Mémoire de DEA - cerbafaso.org

BURKINA FASO
UNIVERSITE DE OUAGADOUGOU
***********
UNITE - PROGRES - JUSTICE
Unité de Formation et de Recherche
Centre de Recherche Biomoléculaire
Sciences de la Vie et de la Terre
CERBA/LABIOGENE
(UFR-SVT)
Département de Biochimie
MEMOIRE
Présenté par
KABORE R. Ibrahim
Maître ès Substances Naturelles et Pharmacodynamiques
Pour l’obtention du :
Diplôme d'Etudes Approfondies en Biochimie/ Biologie Moléculaire
SUR LE THÈME :
Suivi de l’évolution des paramètres biologiques chez les patients
séropositifs VIH traités au Centre de Recherche Biomoléculaire
de Ouagadougou
Soutenu le 17/12/ 2010, devant le jury :
Président : Pr. Odile NACOULMA, Professeur Titulaire, Université de Ouagadougou
Membres : Pr. Jacques SIMPORE, Professeur Titulaire, Université d e Ouagadougou
Dr. Virginio PIETRA, Università di Brescia, Italia, invité
Pietro Annigoni (CERBA) et au Centre Médical Saint Camille (CMSC)
***********

i
DÉDICACE
À mon père, feu El Hadji KABORE Nobila Hamadou,
À ma chère mère KABORE/OUEDRAOGO Zénabou,
À mes frères et soeurs : Ousséni, Mariétou Mariam, Alizéta, Habibou
À toutes les personnes qui vivent avec le VIH/SIDA et toutes celles qui s’investissent pour
leur cause.

ii
REMERCIEMENTS
Ce travail a été réalisé dans les laboratoires d’immunologie et de biologie moléculaire
du centre médical Saint Camille et du Centre de Recherche Biomoléculaire Pietro Annigoni
(CERBA/LABIOGENE). Nous exprimons notre profonde gratitude :
Au Pr Odile Germaine NACOULMA, responsable de l’école Doctorale (Département
de Biochimie/Microbiologie) pour avoir accepté de présider notre jury ;
Au Pr Jacques SIMPORE, directeur du CERBA/LABIOGENE, du laboratoire du
CMSC et Recteur de l’Université Saint Thomas d’Aquin USTA pour avoir accepté la
direction de ce DEA, pour le choix pertinent de ce thème, pour le support économique de
cette étude et pour son encadrement exceptionnel ;
Au Pr Boukaré ZEBA, chef du département de Biochimie/Microbiologie,
Au Pr Jeanne MILOGO/RASOLODIMBY, et au Pr Jean-Baptiste NIKIEMA pour
leur, disponibilité, leurs conseils, leurs encouragements, et leur assistance morale ;
Au Dr Virginio PIETRA pour avoir accepté d’évaluer notre travail,
Au Dr. W.M. Christelle NADEMBEGA pour ses conseils et pour l’aide qu’elle nous a
apportée dans la réalisation de ce travail ;
Au Dr. Charlemagne GNOULA pour ses conseils et pour nous avoir aidés dans nos
recherches bibliographiques ;
A tous les enseignants-chercheurs du département de Biochimie/Biologie Moléculaire
Appliquée/ Substances Naturelles/ Plantes médicinales et Phytothérapie pour la qualité de la
formation reçue ;
Au Dr. Djeneba OUERMI notre aînée pour son aide et ses conseils,
Au Dr. Korotimi SANOGO de l’ambulatoire des adultes du CMSC pour ses
explications éclairées,
A toute l’équipe du Laboratoire Saint Camille, en particulier mesdames Justine YARA,
Angèle SANFO et monsieur Emmanuel BOUDA pour leurs précieux conseils et leur

iii
assistance apportée lors des manipulations ;
A la Conférence épiscopale italienne (CEI), pour leur soutien financier dans la
réalisation de nos travaux de mémoire de DEA ;
A tous les étudiants de notre promotion pour la bonne ambiance, les conseils et les
encouragements ;
À nos oncles et tantes, cousins, cousines, amis et amies pour leurs encouragements ;
À tous ceux qui nous ont soutenus dans nos études scolaires et universitaires.

iv
SOMMAIRE
DÉDICACE ................................................................................................................................ i
REMERCIEMENTS ................................................................................................................ ii
Liste des sigles et abréviations ............................................................................................... vii
RESUME ................................................................................................................................ viii
Introduction .............................................................................................................................. 1
CHAPITRE I– GÉNÉRALITÉS ............................................................................................ 3
I. Structure des Virus de l'Immunodéficience Humaine ...................................................... 4
I. 1 – Morphologie .................................................................................................................... 4
I. 2 Organisation génomique ................................................................................................... 5
II. Variabilité génétique ........................................................................................................... 6
II.1 La variabilité de la glycoprotéine gp120 ......................................................................... 6
I.2. Diversité du VIH : .............................................................................................................. 7
IV. Les cellules cibles du VIH ............................................................................................... 11
IV .1. Les cellules lymphocytaires du sang ........................................................................... 11
IV.1.1 Les lymphocytes T-auxiliaires (T-helpers ou Th) : .................................................. 12
IV.1.2 Les lymphocytes T-cytotoxiques (Tc) : ..................................................................... 12
IV.2 Réponse immunitaire de l'organisme de l’hôte au VIH : ........................................... 12
IV.2.1 Réponse Humorale : ................................................................................................... 12
IV.2.2 Réponse cellulaire : ..................................................................................................... 12
IV.2.2.1 immunité non spécifique : ....................................................................................... 12
IV.2.2.2 immunité spécifique : ............................................................................................... 12
IV.2.3. L'épuisement du système immunitaire : .................................................................. 13
V. La transmission du VIH : ................................................................................................ 13
VI. Ethiopathologie ............................................................................................................... 14
VI.1. Les non-progresseurs à long terme : ........................................................................... 15
VI.2 La résistance à l'infection : ........................................................................................... 15
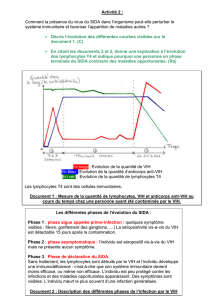
VII. Le diagnostic biologique ............................................................................................... 15
VII.1 : le diagnostic sérologique ............................................................................................ 16
VII.1.1 Cinétique des marqueurs de l’infection à VIH ....................................................... 16
VII.1.1.1 Les immunoglobulines ........................................................................................... 16
VII.1.1.2 La glycoprotéine p24 .............................................................................................. 16
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
1
/
73
100%