DS UV T1 CHIMIE (2h30) a. Toutes les

I.N.S.A.2 jeudi 26 janvier 2006
DS U.V. T1 CHIMIE (2h30)
Calculatrice et document polycopié “thermodynamique chimique” autorisés
Les exercices 1 et 2 sont indépendants et doivent être traités sur 2 copies séparées.
Indiquer et respecter la numérotation des questions.
a. Toutes les réponses doivent être soigneusement justifiées
Barème approximatif : exercice 1 : 40% exercice 2 : 60%
EXERCICE 1 : copie n°1
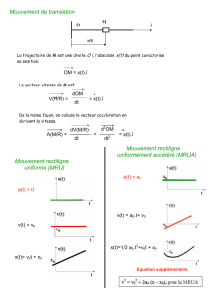
Explosion du trinitrotoluène (TNT).
Le TNT est un explosif de haute puissance.
CH3NO2
O2N
NO2
H H
TNT
Données :
Formule brute : C7H5N3O6
Masse molaire : 227 g.mol-1
Masse volumique : 1.59g/cm3
∆fH°(TNT,s,298K) = - 63.2 kJ.mol-1 ; ∆fH°(H2O,g,298K) = - 241.8 kJ.mol-1
R = 8,314 J.mol-1.K-1
composés TNT(s) O2(g) N2(g) H2O(g) C(gra,s)
Cv°(298K) J.mol-1.K-1 243.3 20.8 21.2 24.0 8.58
On supposera les Cv° indépendants de la température.
On s’intéresse à la réaction d’explosion d’un bloc de TNT.
4TNT(s) = 14C(gra) + 7O2(g) + 6N2(g) + 10H2O(g)
Cette réaction quasi-totale est caractérisée par une cinétique extrêmement rapide. Ce qui fait qu’une fois la
réaction terminée le volume du système est le même qu’au départ. L’augmentation de la pression provoque
ensuite l’expansion des gaz générés par la réaction chimique qui donne une déflagration (vitesse des gaz plus
rapide que la vitesse du son).
1) Calculer ∆rH°(298K) en déduire ∆rU°(298) pour cette réaction.
2) Montrer que, pour calculer ∆rU°(T) on peut établir une relation analogue à la loi de Kirchhoff .
3) En déduire l’expression de ∆rU°(T).
4) On s’intéresse à l’explosion de 1 kg de TNT à 298K dans des conditions isotempérature et isochore.
a) Calculer le volume initial du TNT.
b) Quelle est la fonction thermodynamique permettant le calcul de la quantité de chaleur dégagée par
le système à volume constant et température constante? Calculer cette quantité de chaleur.
c) Quelle sera la pression finale obtenue ?
5) On se place maintenant dans des conditions réelles d’explosion où la température du système varie.
On réalise la réaction avec 1kg de TNT dans des conditions isochores (juste avant la déflagration). De plus
l’explosion étant très rapide, les échanges thermiques n’ont pas le temps de ce faire avec le milieu extérieur.
a) Calculer la température atteinte par le système une fois la réaction effectuée.
b) En déduire la pression finale du système. Conclusion ?
DS T1 chimie 05-06 1/2

EXERCICE 2 : copie n°2
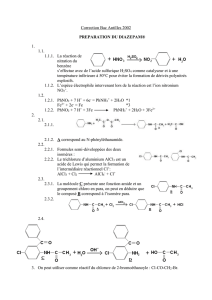
A) Le trichlorure d'aluminium gazeux AlCl3, existe sous forme dimérisée Al2Cl6
On étudie la réaction de dissociation du dimère Al2Cl6 d'équation :
(1) Al2Cl6(g) = 2 AlCl3(g)
Al2Cl6(g) AlCl3(g)
∆fHO(Bi,298)(kJ.mol -1) -1290,8 -587,2
A1) Montrer que la température est facteur d’équilibre.
A2) Faire le bilan des paramètres intensifs facteurs d’équilibre descriptifs du système constitué par le
mélange des deux gaz. Ecrire les équations reliant ces paramètres. En déduire la variance du système. Vérifier
en utilisant la règle de GIBBS.
A3) Influence des conditions opératoires.
A3-a) Dans quel sens le système chimique évolue-t-il lorsque on lui impose une augmentation
isotherme de la pression ?
A3-b) Dans quel sens le système chimique évolue-t-il lorsque on lui impose une augmentation
isobare de la température ?
A3-c) Etablir l'expression de dA permettant de trouver l'influence de l'addition de gaz inerte N2, à T
et P constantes ?
A4) Montrer que donner ∆rGo
1(T) sous la forme A + BT, A et B étant deux constantes, c’est considérer
l'enthalpie standard de réaction ∆rHo
1 et l'entropie standard de la réaction ∆rSo
1 indépendantes de la température.
A5) Calculer ∆rSo
1 en utilisant l’hypothèse du A4, et sachant que la température d'inversion vaut 883K.
A6) On étudie la dissociation de Al2Cl6 (introduit seul) à 800K sous la pression de 0,5 bar
A6-a) Montrer que Ko
1 (800) = 0,193
A6-b) Calculer la fraction molaire du monomère AlCl3 dans le mélange gazeux à l'équilibre.
A7) A quelle température, à l'équilibre, 99 % du dimère a-t-il disparu sous la pression de 0,5 bar ?
B) A température plus élevée, le trichlorure d'aluminium gazeux, maintenu au contact du métal aluminium
(Al), est partiellement réduit en dichlorure (AlCl2) et monochlorure (AlCl) selon 2 réactions d'équations :
(2) Al (l) + 2 AlCl3 (g) = 3 AlCl2(g) ln(K2) = 17,68 – 34680/T
(3) 2 Al (l) + AlCl3 (g) = 3 AlCl(g) ln(K3) = 29.84 − 45400/Τ
B1) Déterminer l'enthalpie standard de la réaction (2).
B2) Calculer la variance du système constitué du mélange des quatre gaz au contact de l'aluminium
liquide. Commenter brièvement le résultat.
B3) Écrire les équations permettant de calculer les fractions molaires des quatre gaz connaissant la
pression P et la température T. (On ne demande pas le calcul de ces fractions molaires)
On notera les fractions molaires :
Al2Cl6 : y6 AlCl3 : y3 AlCl : y1 AlCl2 : y2
B4) On peut penser, que dans le milieu réactionnel le dichlorure d'aluminium se dismute :
(4) 2AlCl2(g) = AlCl3 (g) + AlCl(g)
Calculer la constante d'équilibre de cette réaction à 1500K.
Bon courage pour la suite et bonnes vacances!
DS T1 chimie 05-06 2/2
1
/
2
100%