dry Les endozépines, ligands endogènes des - iPubli

S SYNTHÈSE
433-43
'
H. Vaud.
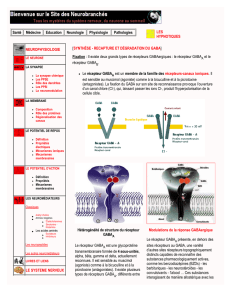
Les endozépines,
ligands endogènes
des récepteurs des
benzodiazépines
L

D,
·
« ••
1


8
»

Cytoplasme � V
0
Matrice
�
ADC
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%