fixation glomérulaire d`auto-anticorps dans la néphrite lupique

FLAMMARION MÉDECINE-SCIENCES — ACTUALITÉS NÉPHROLOGIQUES 2008
(www.medecine.flammarion.com)
FIXATION GLOMÉRULAIRE D’AUTO-ANTICORPS
DANS LA NÉPHRITE LUPIQUE :
LA QUESTION EST-ELLE RÉGLÉE ?
par
J.H.M. BERDEN, C.C. VAN BAVEL et J. VAN DER VLAG*
Chez un patient atteint de lupus avec atteinte rénale, la biopsie peut mettre en évi-
dence différentes anomalies histologiques [1]. L’examen en immunofluorescence
met systématiquement en évidence des dépôt composés d’immunoglobulines (Ig) et
de complément. Suivant le degré des anomalies, ces dépôts sont localisés au moins
dans le mésangium (néphrite lupique des classes I et II de la classification ISN/RPS),
mais sont également observés très fréquemment le long de la paroi des capillaires
glomérulaires au niveau sous-endothélial (classes III et IV de la classification ISN/
RPS) ou extramembraneux (classe V de la classification ISN/RPS). La microscopie
optique révèle que les dépôts sous-endothéliaux sont accompagnés de lésions proli-
fératives constituées d’une prolifération endocapillaire, d’une infiltration par des cel-
lules inflammatoires, d’une nécrose de l’anse capillaire et dans certains cas, d’une
prolifération extracapillaire avec formation de croissants. Des dépôts importants
associés à ces lésions aiguës peuvent également être observés le long de la paroi
capillaire (anses en fil de fer ou wire loops). L’examen au microscope électronique
montre que ces dépôts sont des structures denses aux électrons, localisées dans le
mésangium, au niveau sous-endothélial et sous-épithélial.
Des recherches ont été conduites depuis de nombreuses années afin de
comprendre comment se forment ces dépôts glomérulaires. Étant donné que le
développement d’une glomérulonéphrite chez un patient lupique est, dans la majo-
rité des cas, accompagné par des titres élevés et souvent croissants d’anticorps anti-
ADN bicaténaire (ADNdb) [2] et de taux abaissés de facteurs de complément C3 et
C4, il a été suggéré que les anticorps anti-ADNdb forment des complexes avec
NÉPHRI
TE
LUPI-
QUE :
FIXA-
TION
GLOMÉ-
RULAIR
J.H.M.
BER-
DEN ET
COLL.
* Laboratoire de Recherche en Néphrologie, Nijmegen Center for Molecular Life Sciences,
Service de Néphrologie, Radboud University Nijmegen Medical Center, Nijmegen, Pays-Bas.

206 J.H.M. BERDEN ET COLL.
l’ADN et que ces complexes se déposent dans le glomérule, fixent le complément
et, par conséquent, attirent les cellules inflammatoires. Ces événements déclenchent
une attaque inflammatoire provoquant des lésions glomérulaires. Pour que ceci soit
vrai, deux hypothèses doivent être vérifiées :
– l’ADNdb est immunogène ;
– les complexes d’anti-ADNdb et d’ADNdb sont néphropathogènes.
IMMUNOGÉNICITÉ DE L’ADNdb
ET D’AUTRES AGENTS NUCLÉAIRES
En raison de la réponse auto-immune dominante contre les ADNdb dans le lupus,
il était logique d’effectuer des essais d’immunisation d’animaux avec de l’ADNdb.
Cependant, ces immunisations avec de l’ADNdb « nu » ou chimiquement modifié
n’ont pas induit la formation d’anticorps présentant des caractéristiques similaires
aux auto-anticorps anti-ADNdb formés chez des patients lupiques. Ces résultats ont
pu être expliqués par des observations ultérieures qui ont démontré clairement que la
réponse auto-immune dans le lupus érythémateux disséminé (LED) est dépendante
des lymphocytes T ce dont témoigne la classe IgG, l’avidité élevée et l’existence de
mutations somatiques observées pour les auto-anticorps du lupus [1]. Pour qu’une
réponse des lymphocytes T soit efficace, il faut que les antigènes soient présentés
sous la forme d’un peptide enfoui dans la cavité des molécules de classe II du
complexe majeur d’histocompatibilité (CMH). Ce complexe peptide-CMH classe II
permet la reconnaissance des antigènes par le récepteur du lymphocyte T. En raison
de sa nature chimique, l’ADNdb ne remplit pas les conditions permettant la présen-
tation par les molécules du CMH de classe II. Cette énigme a été élucidée par
l’observation que, pour obtenir une réponse correcte à l’ADNdb, celui-ci doit être
complexé à une protéine. Les premières observations indiquant qu’une réponse anti-
ADNdb peut être induite dans une telle conformation ont été effectuées avec la pro-
téine de liaison d’ADN de protozoaire Fus1 décrite dans [3], ou avec l’antigène
grand T du virus du polyome [4]. Apparemment, ces protéines imitent un des
ligands naturels de l’ADNdb : les histones. La reconnaissance par les lymphocytes T
de ces protéines microbiennes/virales met en place les conditions nécessaires à la
reconnaissance par les récepteurs des lymphocytes T de peptides dérivés d’histone
qui à leur tour stimulent les lymphocytes B ayant un récepteur pour l’ADNdb [5].
Parallèlement, il a été mis en évidence, à la fois chez des souris lupiques et des
patients LED, que le nucléosome est l’auto-antigène déclencheur dans le LED. Ce
résultat est basé sur plusieurs observations :
– dans le lupus murin plus de 50 p. 100 des clones de lymphocyte T répondent à
une stimulation par les nucléosomes [6] ;
– dans le lupus humain, des observations similaires ont été effectuées [7, 8] ;
– dans le lupus murin, des anticorps spécifiques de nucléosome apparaissent
avant le développement d’autres réponses antigéniques anti-nucléaires telles que
anti-ADNdb et anti-histone, qui apparaissent en conséquence du phénomène
d’epitope spreading [9] ;
– chez les patients lupiques, la prévalence des anticorps anti-nucléosome est beau-
coup plus élevée et de plus grande sensibilité que les anticorps anti-ADNdb [10-12].

NÉPHRITE LUPIQUE : FIXATION GLOMÉRULAIRE D’AUTO-ANTICORPS 207
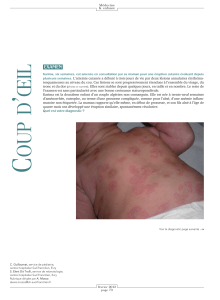
Mais pourquoi un nucléosome devient-il immunogène ? Le nucléosome est la
structure de base de la chromatine. Il est constitué d’une protéine centrale, formée
par des paires d’histones H2A, H2B, H3 et H4. Autour de cet octamère d’histone,
un brin d’ADNdb est enroulé deux fois, l’histone H1 étant située à l’extérieur,
comme un doigt sur un nœud pour maintenir la bobine (fig. 1). Les nucléosomes
sont interconnectés par de l’ADNdb nu, ce qui donne à la chromatine dans son état
déroulé l’aspect de « perles sur un cordon ». Mais pourquoi ces structures, qui sont
normalement inaccessibles dans le noyau (puisque entourées par la membrane
nucléaire, le cytoplasme et la membrane cellulaire), deviennent-elles des cibles du
système immunitaire ? Des recherches importantes conduites par l’équipe de
Rosen [13] et d’autres [14] ont démontré que ces structures nucléaires apparaissent
à la surface des cellules lors de l’apoptose. Ce processus de mort cellulaire pro-
grammée commence par le clivage par des endonucléases des brins d’ADNdb
interconnectés, qui produit des nucléosomes libres. Après fragmentation du noyau,
ces nucléosomes sont transportés vers des petits corps/vésicules apoptotiques à la
surface de la membrane cellulaire. Normalement, ce processus d’apoptose conduit
à l’exposition de plusieurs signaux « eat me » à la surface de la cellule qui, en
association ou non des molécules de pontage, sont reconnus par différents récep-
teurs sur les cellules phagocytaires spécialisées, telles que les macrophages, mais
également par les cellules voisines. Cette reconnaissance permet une élimination
rapide et efficace, et donc non phlogistique, des cellules apoptotiques [15]. Cepen-
dant, si ce système d’élimination est déficient, l’apoptose continue et des vésicules
sont libérées par les cellules mourantes. Ces vésicules contiennent différentes
molécules telles que des constituants de nucléosomes et de splicéosomes [13]. Un
autre risque d’une élimination déficiente des cellules apoptotiques est que ces
auto-antigènes putatifs sont modifiés durant l’apoptose par différents mécanismes
tels que le clivage par des caspases et le granzyme B, ou par (dé)phosphorylation,
ubiquitinylation, ou citrullination [16, 17].
En fait, il a été établi que si une protéine est susceptible de subir des modifi-
cations induites par l’apoptose, elle est prédestinée à devenir un auto-antigène
dans des maladies auto-immunes systémiques [16] telles que le LED [18]. Par
conséquent, si l’élimination de matériau dérivé de cellules apoptotiques est
déficient, ces structures modifiées, et donc plus immunogènes, peuvent devenir
H3
H4
H2A H2B
H1
FIG. 1. — Topographie du nucléosome. Le nucléosome est constitué d’une protéine
centrale comprenant des paires d’histones H2A, H2B, H3 et H4. L’ADNdb est
enroulé autour du corps cylindrique de ces histones. Ce complexe est maintenu par
l’histone H1, qui est positionnée comme un doigt sur un nœud.

208 J.H.M. BERDEN ET COLL.
des cibles pour une réponse auto-immune. Nos observations récentes illustrent
l’impact des modifications induites par l’apoptose dans la pathogenèse du LED
[19]. En effectuant, avec des anticorps monoclonaux anti-chromatine dérivés de
lupus, le criblage d’une bibliothèque de présentation de peptides à la surface de
phage, nous avons découvert qu’un de ces anticorps monoclonaux, appelé
KM2, reconnaissait un peptide fortement homologue à l’histone H4 (résidus 5-
18). Cependant, le peptide de phage KM2 ne contient pas les résidus lysine en
position 8, 12 et 16, qui sont normalement présents dans H4 natif. Il doit être
noté que ces positions lysine peuvent être acétylées. En effet, KM2 se lie
10 fois plus à un peptide synthétique H4 1-20 acétylé à ces positions qu’au
même peptide non acétylé. Nous avons pu démontrer par la suite que cette
acétylation de H4 se produit durant l’apoptose. Cette hyperacétylation résulte
d’une augmentation significative de l’activité histone acétyl-transférase et
d’une diminution significative de la désacétylation d’histone durant l’apoptose.
La validité in vivo de cette hyperacétylation de H4 induite par l’apoptose est
étayée par plusieurs observations :
– des sérums de souris MRL/lpr lupiques et de patients LED fixent plus forte-
ment H4 acétylé que le peptide H4 non acétylé ;
– l’hypersensibilité retardée, qui est une mesure de la réactivité des lympho-
cytes T, est plus élevée pour H4 acétylé que pour H4 non acétylé chez des sou-
ris MRL/lpr, et est absente chez des souris témoins de CMH correspondant ;
– l’administration de H4 acétylé à de jeunes souris MRL/lpr accélère la pro-
gression de la maladie, traduite par une aggravation des lésions cutanées, une pro-
téinurie plus élevée, des dépôts glomérulaires d’Ig plus importants et une
mortalité plus élevée. Ceci n’a pas été observé après administration de H4 non
acétylé.
Par conséquent, des vésicules dérivées de cellules apoptotiques remplies
d’auto-antigènes modifiés représentent un signal de danger potentiel pour le
système immunitaire. En effet, des résultats récents, non publiés, de notre labo-
ratoire indiquent que les vésicules apoptotiques sont préférentiellement absor-
bées par les cellules dendritiques immatures. Cette absorption conduit à une
activation des cellules dendritiques, mesurée par une augmentation de l’expres-
sion de CD40, CD86 et du CMH de classe II et une augmentation de la produc-
tion d’IL-6 et de TNF-α. Sur le plan fonctionnel, ces cellules dendritiques,
après absorption de vésicules apoptotiques peuvent, dans un système allo-
génique, activer des lymphocytes T (prolifération et production d’IL-2). Des
observations similaires ont été effectuées dans un système syngénique avec des
cellules dendritiques de souris MRL/lpr exposées à des nucléosomes hyper-
acétylés, tandis que des nucléosomes dérivés de cellules normales sont moins
efficaces. Ces observations, parmi d’autres [20], démontrent que les signaux
danger, ainsi que d’autres, peuvent faire passer des cellules dendritiques d’un
état tolérogénique à un état immunogène.
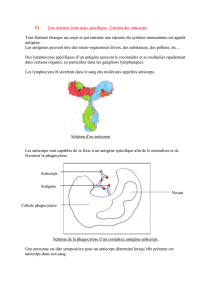
Une fois que les lymphocytes T sont activés, ils peuvent stimuler non seule-
ment des lymphocytes B avec un récepteur de nucléosomes, mais également des
lymphocytes B avec des récepteurs d’ADNdb et d’histone. L’ensemble des anti-
corps anti-chromatine peuvent être induits par epitope spreading [21]. La
séquence de ces événements est représentée sur la fig. 2.
Pour conclure cette partie, l’ADNdb n’est pas lui-même directement immuno-
gène dans le lupus. Le nucléosome est l’auto-antigène déclencheur dans le LED.

NÉPHRITE LUPIQUE : FIXATION GLOMÉRULAIRE D’AUTO-ANTICORPS 209
NÉPHROPATHOGÉNICITÉ DE COMPLEXES
ANTI-ADNdb/ADN
Étant donné que la néphrite lupique est considérée comme un prototype de
maladie par complexes immuns, les complexes ADNdb/anti-ADNdb étaient des
candidats logiques pour ces complexes pathogènes et néphropathogènes. Cepen-
dant, des complexes synthétiques d’ADNdb et d’anticorps anti-ADNdb ne sont
pas localisés dans la membrane basale glomérulaire (MBG) après injection
intraveineuse à des animaux de laboratoire. Ils sont éliminés rapidement et sont
principalement localisés dans le foie et la rate. La technique de génération
d’anticorps monoclonaux par hybridome, récompensée par un Prix Nobel, a
apporté de nouvelles possibilités d’étude. Non seulement des anticorps mono-
clonaux anti-ADNdb dérivés de souris et de patients lupiques se lient à
l’ADNdb, mais ils présentent également une polyréactivité croisée relativement
large avec d’autres antigènes [22]. Ce phénomène de « réactivité croisée » est
une caractéristique particulière de ces anticorps monoclonaux qui peuvent se
lier à la MBG in vitro ou au glomérule in vivo après inoculation intrapéritonéale
d’hybridomes produisant ces anticorps monoclonaux [23]. Par conséquent, sur
la base de ces observations, il a été suggéré que des anticorps anti-ADNdb
peuvent se lier par réaction croisée à des antigènes glomérulaires intrinsèques.
Cette possibilité a été étayée par la découverte que certains antigènes gloméru-
laires tels que la laminine [24] ou l’α-énolase [25] sont effectivement des cibles
Élimination diminuée des
cellules apoptotiques
Captation de l'auto-antigène
par les cellules dendritiques
Apoptose
non contrôlée
Modification des
auto-antigènes
Formation des complexes
nucléosomes/antinucléosomes
Liaison à la membrane par
l'intermédiaire du nucléosome
Activation des
cellules T et
stimulation
des cellules B
FIG. 2. — Représentation schématique de la séquence d’événements dans la réponse auto-
immune dans le LED, comprenant la liaison de complexes néphropathogènes dans des
tissus cibles, représentés sur cette figure par la membrane basale glomérulaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%