Des taux de mortalité inacceptables mettent fin aux

ISIS Santé Clonage
Des taux de mortalité inacceptables mettent
fin aux expérimentations sur le clonage animal
en Nouvelle-Zélande
Unacceptable death rates end cloning trials in New Zealand
Le laboratoire gouvernemental néo-zélandais a annoncé la fin de clonage animal, huit ans
après que le scientifique qui avait inauguré cette pratique, l’avait abandonnée précisément
pour les mêmes raisons. Dr. Mae-Wan Ho
Rapport de l’ISIS 28/03/2011
S'il vous plaît à diffuser largement et à transmettre à vos représentants politiques
L’article original en anglais s’intitule Unacceptable death rates end cloning trials in New Zealand ;
il est accessible sur le site www.i-sis.org.uk/death_rates_end_cloning.php
Est-ce la fin du clonage animal ?
L’Agence scientifique nationale de Nouvelle-Zélande ‘AgResearch ‘ est contrainte de mettre fin à ses
essais sur le clonage des animaux, suite à « des taux de mortalité inacceptables » [1]. Mais cette agence
continuera à créer davantage d'organismes génétiquement modifiés (OGM) chez des animaux, en
utilisant une nouvelle méthode de recherche appliquée.
L'agence a publié des rapports - obtenus par le journal The Dominion Post en vertu de la Loi sur les
renseignements officiels – qui mentionnent notamment des cas d'arthrite chronique, de pneumonie, de
boiterie et un empoisonnement du sang, parmi les causes de décès chez les divers bovins, ovins et
caprins.
Les rapports comprennent des essais et expérimentations sur les organismes génétiquement modifiés
(OGM) animaux pour la production de "super lait", ainsi que des animaux clonés. Le clonage et les
modifications génétiques sont étroitement liés (voir [2] Cloned Meat & Milk Coming, Be Very
Afraid, SiS 50) *.
* La version en français s’intitule "De la viande et du lait provenant d’animaux clonés : il y a de
quoi s’inquiéter" par le Dr. Mae-Wan Ho, traduction et commpléments de Jacques Hallard ; elle est
accessible sur http://yonne.lautre.net/spip.php?article4792&lang=fr

Le directeur général Jimmy Suttie, chargé des applications biotechnologiques, a déclaré que la décision a
été prise après 13 ans d'étude pour savoir comment prévenir les anomalies chez les animaux clonés, et
que « c’est amplement suffisant ».
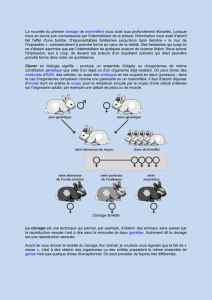
Le clonage par transplantation nucléaire provoque des taux élevés de
mortalité et des anomalies
Le clonage par transplantation nucléaire (NT) consiste à transférer le noyau d'une cellule de l'adulte
ou de l'embryon en développement, dans un ovule mature auquel on a retiré le noyau. Les œufs
reconstitués sont activés pour se développer et les embryons qui en résultent sont implantés dans des
mères porteuses. La technologie est particulièrement inefficace et il est bien connu que ce mode de
clonage entraîne une mort horrible et les déformations chez les clones et comme chez les mères
porteuses.
En 2003, Ian Wilmut, pionnier de la technologie, avait lui-même abandonné le clonage des animaux [3]
(Death Sentence on Cloning, SiS 19), indiquant qu'il allait utiliser la transplantation nucléaire NT,
seulement pour créer des cellules humaines en vue de la réparation tissulaire et pour étudier les maladies
humaines. Cependant, la découverte selon laquelle les cellules humaines ordinaires pourraient être
incitées à devenir des cellules souches, a rendu la transplantation nucléaire NT complètement redondante
[4].
Chez des animaux normaux non OGM, mais provenant d’un clonage par transplantation nucléaire NT, au
plus 10 pour cent des embryons clonés choisis pour l'implantation ont des chances de survivre à l’issue
des essais [1]. (En termes d'embryons totaux réalisés par des transplantations nucléaires NT, le taux
serait d'environ 1 pour cent.) Les principaux problèmes ont été des avortements spontanés et des cas
d’anasarque, chez lesquels l'utérus de la mère porteuse se remplit d'eau et l'animal doit être abattu.
Le Comité d’éthique pour les animaux en Nouvelle-Zélande a signalé 16 foetus ou des veaux obtenus à
partir du milieu de la période de gestation, qui ont avorté spontanément ou qui sont morts dans la
période néonatale en 2010. Dix autres fœtus ou veaux ont dû être euthanasiés chez 14 vaches.
Des modifications génétiques sans faire appel au clonage ?
Bien que les essais de clonage aient été abandonnés, l’Agence néo-Zélandaise AgResearch continuera à
développer des animaux transgéniques chez les bovins, ovins et caprins. Suttie a dit est qu’il est peu
probable que les nouvelles technologies utilisant des cellules souches embryonnaires pour créer des
animaux transgéniques, puissent causer des taux de mortalité comme le clonage.
Cependant, la recherche n’a fait que commencer il y a quatre mois. En 2010, lors d’une procédure
expérimentale pour développer des chèvres transgéniques, deux des petits sur douze qui avaient été
délivrés à terme, sont morts à la naissance. L’un souffrait d'arthrite chronique dans ses pattes de
devant. Quatre autres animaux sont morts ou ont dû être euthanasiés dans un autre protocole
expérimental pour produire des bovins transgéniques.

Suttie dit que le travail chez AgResearch serait bénéfique pour la Nouvelle-Zélande. Les essais
comprennent des travaux pour créer des animaux qui produisent des protéines ayant des usages
pharmaceutiques. Un objectif était de produire un médicament comme la Herceptine, de manière plus
rentable et la rendre ainsi plus facilement disponible. La Herceptine est un médicament anticorps
monoclonal utilisable pour le traitement de certains cancers du sein ; il coûte 100.000 $ par année de
traitement, mais il est controversé du fait qu’il est associé à un risque élevé de décès par maladie
cardiaque [5].
L'annonce de la fin du clonage par AgResearch manque de crédibilité en raison du fait que cette Agence
gouvernementale va continuer ses travaux avec le développement des animaux transgéniques. Tous les
signes sont là pour indiquer que les OGM animaux et le clonage vont de pair, étant donné que la
motivation première de la transplantation nucléaire NT était de créer «des troupeaux d'élite» à partir des
animaux génétiquement modifiés pour produire des médicaments dans leur lait [2]. C'est aussi pourquoi
le clonage avec transplantation nucléaire NT se poursuit aux États-Unis.
Une voie possible et alternative pour la création d'animaux clonés transgéniques se fait par modification
génétique de cellules qui pourraient ensuite être transformées en cellules souches pluripotentes
induites (ou cellules iPS) [4]. Les cellules iPS sont ensuite injectées dans un embryon tétraploïde fait
par la fusion des deux cellules d'un embryon ordinaire à un stade de deux cellules, grâce à un courant
électrique, afin que la cellule qui en résulte comporte quatre compléments de chromosomes (tétraploïde)
au lieu de deux normalement (diploïdes).
Ces embryons tétraploïdes ne se développent pas dans les organismes vivants, sauf lorsque des cellules
souches embryonnaires ou des cellules iPS y sont implantées. L'embryon pourrait alors se développer à
partir des cellules iPS, tandis que les cellules tétraploïdes donnent lieu à des tissus extra-
embryonnaires. Cette procédure expérimentale a été effectuée avec un certain succès chez la souris [6],
bien qu'il soit encore difficile de savoir si cela fonctionnerait chez une autre espèce. Jusqu'à présent, les
cellules iPS ne sont pas encore créées à partir des animaux d'élevage.
Les études publiées confirment la mortalité et les taux d'échecs dans le
clonage par transplantation nucléaire
L'efficacité du clonage par transfert nucléaire, mesurée comme la proportion des embryons clonés
transférés dans des mères porteuses, qui survivent jusqu'à l'âge adulte, est de 9 pour cent chez
AgResearch, selon une étude publiée par l'agence en 2009 [7]. La proportion de survivants à
terme est de 14 pour cent, mais de nouvelles pertes se produisent avant le sevrage. Ces chiffres
se comparent défavorablement par rapport à la FIV, où environ 30 pour cent se développent en
veaux en bonne santé au moment du sevrage.
Le faible taux de survie des embryons clonés est généralement attribué à la nature imprévisible de la
reprogrammation induite par les transplantations nucléaires NT du noyau donneur et à des
changements marqués dans le modèle de transcription et l'identité épigénétique de la cellule oeuf
hybride. Ces réactions de reprogrammation sont initiées dans le cytoplasme de la cellule œuf
immédiatement après le transfert du noyau donneur. Bien que certains des gènes nécessaires à la
reprogrammation soient connus, il est encore impossible de prévoir ou d'influencer l'efficacité du

clonage d’une façon fiable.
Les analyses de microarray [voir la rubrique Puces à ADN dans la partie ‘Définitions & Compléments in
fine] révèlent des différences importantes entre les transcriptomes (la totalité des transcriptions)
résultant de la transplantation nucléaire NT, par rapport aux embryons fécondés ou artificiellement
activés. Plus de 95 pour cent des gènes ont été reprogrammés, mais aucun ensemble distinct de gènes
mal exprimés n’a été trouvé dans les embryons après transplantation nucléaire NT. Les protéomes (la
totalité des protéines exprimées), - avec beaucoup de protéines en faibles quantités et portant souvent
des modifications post-traductionnelles -, sont plus difficiles et plus complexes à analyser : elles n’'ont pas
été profilées en détail dans les clones provenant de transplantation nucléaire NT.
Aucune corrélation n’est observée entre l'efficacité de clonage et l'état de
différenciation des cellules du donneur
L'hypothèse selon laquelle l'efficacité de clonage est inversement corrélée à l'état différencié de la cellule
donneuse n'a pu être confirmée. Une fois que le zygote (ovule fécondé) commence à se développer et à
se diviser en petites cellules appelées blastomères, la reprogrammation décline. Chez la souris, il y a un
net recul en matière d'efficacité du clonage entre les stades de 4 à 8 cellules, ce qui est compatible avec
l'idée que les blastomères de souris de quatre à huit cellules sont encore totipotents, c'est à dire capables
de donner lieu à tous les types d’embryons et de cellules extra-embryonnaires. Ainsi, l’utilisation des
noyaux, soit du zygote, soit des cellules ‘cumulus’ (qui entourent l'ovule en développement dans
l'ovaire), donne des rendements de clonage de 34 (premier cas) contre 3 pour cent (second cas) ; et en
utilisant des noyaux à partir d'un embryon de 4 cellules fœtales, d’une part, et des fibroblastes de fœtus,
d’autre part, les résultats en efficacité du clonage sont respectivement de 43 et de 3 pour cent.
Selon la même hypothèse, les cellules souches, qui sont indifférenciées et multipotentes (capables de
donner naissance à plus d'un type de cellule), devraient donner une plus grande efficacité de clonage que
les cellules somatiques différenciées, mais cela n'a pas été confirmé par de nombreuses
expérimentations. Les cultures de cellules souches embryonnaires sont connues et réputées pour leur
instabilité épigénétique et l'accumulation d'anomalies chromosomiques, ce qui les rend non
reprogrammables. Les modèles de méthylation de l'ADN (une forme courante de marquage génétique) et
l'expression de gènes soumis à une empreinte (gènes exprimés selon qu'ils proviennent de la mère ou du
père) varient considérablement entre les lignées de cellules souches embryonnaires et entre les sous-
clones d'une lignée de cellules souches embryonnaires donnée, et même entre les cellules individuelles
dans un sous-clone.
Les cellules souches et les cellules progénitrices (provenant de cellules souches embryonnaires avant
qu'elles ne se différencient en différents types cellulaires précises) ont été évaluées en tant que donneurs
de noyaux dans sept lignées somatiques différentes – ‘antier’, tissu adipeux, sang, moelle osseuse,
muscles, cerveau et peau - et de quatre espèces différentes : souris, bovins, porcs et cerfs. Cela a
représenté 10 pour cent du nombre total des différents types de cellules des mammifères. Il n'y avait
aucune amélioration substantielle de l'efficacité de clonage des cellules souches par rapport aux cellules
somatiques. Le chercheur résume ainsi [7]: « aucune corrélation concluante [entre l'efficacité de clonage
et l'état de différenciation] n’a été constatée, indiquant que le type de donneur de cellules somatiques ne
peut pas être le facteur limitant pour le succès du clonage succès ».

Des espoirs placés dans de nouvelles cellules souches
Cependant, beaucoup d'espoir a été porté sur une nouvelle méthode de création des cellules souches
pluripotentes qui sont capables de produire toutes les cellules de l'embryon à l'exception des tissus extra-
embryonnaires.
Les cellules souches pluripotentes induites (cellules iPS) sont obtenues après que les cellules
somatiques aient été transduites (infectées) avec un vecteur d'expression d'un ensemble de facteurs de
transcription spécifiques. De telles cellules iPS sont pratiquement impossibles à distinguer des cellules
souches embryonnaires (ES) quant à la morphologie des cellules, à l'expression des gènes et à leur
pluripotence. Le chercheur a considéré ces cellules comme « les candidats les plus prometteurs pour
l'avenir des expériences de tranfert nucléaire NT somatique », et il a souligné « l'importance de la
dérivation de ces cellules chez les diverses espèces de bétail »
On n’est pas certain que les nouvelles expériences mentionnées par le Dominion Post [1] , sur la création
d'animaux transgéniques, ont été réalisées avec des cellules iPS. Si c'est le cas, les taux élevés de
mortalité et d’anomalies ont à peine diminué.
Il est grand temps de mettre fin à toutes les tentatives pour créer des animaux génétiquement modifiés
[OGM] ou pour cloner des animaux par transplantation nucléaire. C’est inacceptable, tant en terme de
souffrance animale que vis-à-vis des risques graves pour la santé [2].
Références
1. “Animal death toll ends cloning trials”, Kiran Chug, The Dominion Post, 21 February
2011,http://www.stuff.co.nz/national/4681283/Animal-death-toll-ends-cloning-
trialshttp://www.stuff.co.nz/national/4681283/Animal-death-toll-ends-cloning-trials
2. Ho MW. Cloned meat & milk coming, be very afraid. Science in Society 50 (to appear).
3. Ho MW and Cummins J. Is FDA promoting or regulating cloned meat and milk? Science in Society 33,
24-27, 2007.
4. Okita K, ichisaka T and Yamanaka S. Generation of germline-competent induced pluripotent stem cells.
Nature 2007, 448, 313-8.
5. Trastuzuma b, Wikipedia, 14 February 2011, http://en.wikipedia.org/wiki/Trastuzumab#Side_effects
6. Boland MJ, Hazen JL, Nazor KL, Rodriguez AR, Gifford W, Martin G, Kupriyanov S ad Baldwin KK. Adult
mice generated from induced pluripotent stem cells. Nature 2009, 461, 91-96.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%