Chap11 Cohesion des solides

Chap 12 1 COHESION DE LA MATIERE A L’ETAT SOLIDE
I Les solides ioniques
1/ Structure d’un solide ionique.
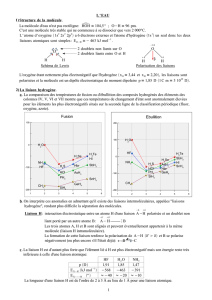
Exemple du chlorure de sodium
Cristal macroscopique
Empilement des ions dans le
cristal
Dans le cristal chlorure de
sodium, il y a ________________
des ions Cl- et Na+.
On trouve les ions Na + :
-
-
On trouve les ions Cl- :
-
-
Un solide ionique (ou cristal ionique) est composé d’anions et de cations disposés de façon ordonnée dans l’espace.
Le nombre d’ions empilés est tel que le cristal ionique est ______________.
___________________________________________________________________________________________
La formule de l’espèce chimique correspondant à un solide ionique, dite formule statistique, tient compte de la
nature des ions (sans mentionner leurs charges) et respecte cette neutralité.
Ex : Formule du chlorure de sodium : ________________
2/ Cohésion du cristal. (Cf exercice 18 p 213
La cohésion d’un solide ionique est assurée par des liaisons ioniques, c’est à dire par des
________________________________
L’empilement des ions est tel que les ___________________________________________________________
____________________________________________________________________________________________
L’ensemble des interactions coulombiennes maintient les ions à leur place au sein du cristal, ce qui lui confère une
grande cohésion.
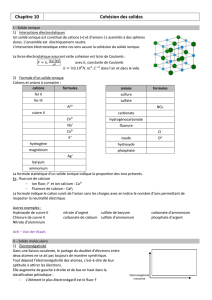
3/ Exemples de solides ioniques.
cations(
formules(
fer II
Fe2+
fer III
Fe3+
aluminium
Al3+
cuivre II
Cu2+
zinc
Zn2+
sodium
Na+
Calcium
Ca2+
potassium
K+
hydrogène
H+
magnésium
Mg2+
Argent
Ag+
baryum
Ba2+
ammonium
NH4+
Hydroxyde de cuivre II : Cu(OH)2 Nitrate d’argent : Ag(NO3) 2 Carbonate de calcium: Ca(NO3)
Nitrate d’aluminium : NH4 NO3 Sulfate de baryum : BaSO4 Sulfate d’ammonium: (NH4)2SO4
Chlorure de cuivre II : CuCl2 Carbonate d’ammonium : (NH4)2CO3 Phosphate d’argent : Ag3PO4
anions
formules
sulfure
S2-
sulfate
SO42-
nitrate
NO3-
carbonate
CO32-
hydrogénocarbonate
H CO3-
fluorure
F-
chlorure
Cl -
oxyde
O2-
hydroxyde
OH-
phosphate
PO4 3-

II Les solides moléculaires
1/ Molécules polaires et apolaires.
a) Electronégativité d’un élément chimique.
Rappel : Une liaison covalente entre deux atomes résulte de la mise en commun par chaque atome d’un électron périphérique,
le doublet d’électrons appartenant à l’un et l’autre des atomes.
L'électronégativité d'un élément est la tendance d'un élément à attirer le doublet d'une liaison covalente dans laquelle il est
engagé.
D'une façon générale,
• l'électronégativité des éléments augmente lorsqu'on se déplace de gauche à droite dans une période (ligne) du tableau
périodique des éléments.
• l'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau
périodique des éléments.
Les alcalins ont tendance à perdre des électrons (ils sont donc peu électronégatifs), alors que les halogènes ont tendance à
gagner des électrons (ils sont donc très électronégatifs). Ainsi, ils peuvent acquérir chacun la structure des gaz nobles.
b) Polarité d’une liaison.
Lorsqu’une liaison covalente implique deux atomes d’électronégativités différentes, les électrons mis en commun dans la liaison
sont attirés par l’atome le plus électronégatif. La liaison est alors dite polarisée.
Tout se passe comme si chaque atome était porteur d’une charge électrique partielle, négative (notée δ- ) pour l’atome le plus
électronégatif, positive (notée δ+) pour l’atome le moins électronégatif.
Exemple : La molécule de fluorure d’hydrogène HF:
c) Polarité d’une molécule
• Cas d’une molécule diatomique
Une molécule diatomique constituée de deux atomes identiques est apolaire. (H2, O2, N2, F2, Cl2, Br2, I2….)
Une molécule diatomique constituée de deux atomes différents est généralement polaire. (HF, HCl, HBr,CO, NO…)
• Cas d’une molécule polyatomique
Une molécule est polaire si elle possède au moins une liaison polarisée et si le barycentre G+ (moyenne géométrique) des
charges partielles positives est différent du barycentre G- des charges partielles négatives.
Exemples :
-Le dioxyde de carbone CO2
Les deux liaisons covalentes C=O sont polarisées mais comme cette molécule est linéaire le
dipôle résultant est nul. Celle molécule est donc apolaire.

- L’eau H2O
Les deux liaisons covalentes O-H sont polarisées. Comme cette molécule est coudée, la
barycentre des charges positives et négatives ne coïncide pas et la molécule est polarisée.
!
2/ Cohésion des solides moléculaires.
Un solide (ou cristal) moléculaire est un assemblage compact et ordonné de molécules.
La cohésion de ces solides moléculaires ne peut donc pas s’expliquer par la force de Coulomb ; elle est assurée par deux
types d’interactions moléculaires :
- l’interaction de Van Der Waals
- les liaisons hydrogène
La cohésion des solides moléculaires est nettement moins forte que la cohésion des solides ioniques.
a) Les interactions de Van Der Waals.
Ce sont des interactions électrostatiques entre les nuages électroniques des molécules (ensemble des électrons
périphériques des atomes constituants la molécule. Elles sont d’autant plus intenses que les liaisons internes aux molécules
sont polaires et que les molécules qui interagissent sont proches.
Ces interactions assurent donc la cohésion des solides mais aussi des liquides ( elles interviennent dans une moindre mesure
dans les gaz car les molécules sont très éloignées les unes des autres).
Les geckos arboricoles, des petits reptiles sont capables de grimper sur les surfaces les
plus lisses, car leurs doigts présentent des sétules, des poils très fins à leur extrémité, qui
créent des interactions de van der Waals au contact du support.
Le doigt est décollé du support par changement d’orientation des poils microscopiques.
b) La liaison hydrogène
Ex : l’eau, constituée de molécules d’eau H2O
L’atome d’oxygène, très électronégatif, d’une première molécule d’eau se trouve fortement attiré par l’atome d’hydrogène d’une
autre molécule d’eau : il se forme entre eux une veritable liaison, appelée liaison hydrogène.
Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un
atome B, également très électronégatif et porteur d’un ou plusieurs doublets non liants.
Toute molécule qui possède des groupes –O-H présente des liaisons hydrogène qui renforcent la cohésion du solide
moléculaire.
Ex : L’éthanol CH3-CH2-OH et le méthoxyéthane CH3-O-CH3, sont deux isomères dont les températures d’ébullition sont
totalement différentes : θ ébu (éthanol) = 78°C et θ ébu (méthoxyéthane) = -25°C. Ceci est du à la présence de liaisons
hydrogène dans l’éthanol.
C2H5O
H
HO
C2H5
Liaisons hydrogène dans l’éthanol

Autre!ex!:!Les!polymères!absorbants!(polyacrylates!de!sodium)!sont!des!polymères!capables!d’absorber!plusieurs!
centaines!de!fois!leur!poids!en!eau.!Ils!sont!utilisés!dans!les!couches.!
!
!
III Chauffage d’un solide et changement d’état physique (Cf Activités documentaires et Expérimentales)
1/ Les états de la matière
• L’état gazeux est un état dispersé. Les molécules et les ions sont éloignés les uns des autres et se déplacent dans
toutes les directions de façon désordonnée. Les interactions entre les entités chimiques sont quasi nulles.
• L’état liquide est un état condensé. Les entités chimiques sont les unes contre les autres et peuvent glisser les unes
sur les autres ; elles sont en mouvement constant.
• L’état solide est aussi un état condensé. Les entités chimiques sont en contact les unes avec les autres. On est en
présence d’un assemblage compact et ordonné. Les entités chimiques sont en vibration constante autour d’une position
d’équilibre.
2/ Transferts thermiques et changements d’état
Les différents changements d’état :
Lors d’un changement d’état, la température d’un corps pur reste constante.
- En recevant de l’énergie par transfert thermique (chaleur), ce corps pur passe à un
état moins ordonné (solide → liquide → gazeux).
- Dans le cas contraire, ce corps pur cède de l’énergie au milieu extérieur.
Explications :
La chaleur reçue par le solide est transformée en énergie cinétique : l’agitation
thermique des molécules qui constituent le solide augmente. Quand cette agitation est
suffisante, des interactions de Van Der Waals, qui assurent la cohésion du cristal sont
rompues et l’édifice cristallin se disloque.
Les molécules restent en contact mais se séparent. Il n’y a plus de disposition régulière dans l’espace. C’est la fusion :
on passe de l’état solide à l’état liquide. Une fois toute l’espèce moléculaire à l’état liquide, l’agitation thermique augmente à
nouveau et la température aussi. Au fur et à mesure que la température augmente, les interactions de Van Der Waals existant
entre les molécules sont de moins en moins nombreuses, puis disparaissent totalement : c’est la vaporisation : on passe de
l’état liquide à l’état gazeux.
Remarque : pour l’eau H2O, en plus des interactions de Van Der Waals, il faut rompre les liaisons hydrogène.
COO-
COO-
COO-
COO-
COO-
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
1
/
4
100%