Cours - PhyZik

Chapitre 10
Cohésion des solides
I – Solide ionique
1) Interactions électrostatiques
Un solide ionique est constitué de cations (+) et d’anions (-) assimilés à des sphères
dures. L’ensemble est électriquement neutre.
L’interaction électrostatique entre ces ions assure la cohésion du solide ionique.
La force électrostatique assurant cette cohésion est la loi de Coulomb :
avec , constante de Coulomb
dans l’air et dans le vide
2) Formule d’un solide ionique
Cations et anions à connaitre :
cations
formules
fer II
fer III
Al3+
cuivre II
Zn2+
Na+
Ca2+
K+
hydrogène
magnésium
Ag+
baryum
ammonium
anions
formules
sulfure
sulfate
NO3-
carbonate
hydrogénocarbonate
fluorure
Cl -
oxyde
O2-
hydroxyde
phosphate
La formule statistique d’un solide ionique indique la proportion des ions présents.
Ex : fluorure de calcium
Ion fluor, F- et ion calcium : Ca2+
Fluorure de calcium : CaF2
La formule indique le cation suivit de l’anion sans les charges avec en indice le nombre d’ions permettant de
respecter la neutralité électrique.
Autres exemples :
Hydroxyde de cuivre II nitrate d’argent sulfate de baryum carbonate d’ammonium
Chlorure de cuivre II carbonate de calcium sulfate d’ammonium phosphate d’argent
Nitrate d’aluminium
Acti – Van der Waals
II – Solide moléculaire
1) Electronégativité
Dans une liaison covalente, le partage du doublet d’électrons entre
deux atomes ne se ait pas toujours de manière symétrique.
Tout dépend l’électronégativité des atomes, c'est-à-dire de leur
aptitude à attirer les électrons.
Elle augmente de gauche à droite et de bas en haut dans la
classification périodique :
L’élément le plus électronégatif est le fluor F
Electronégativité
croissante

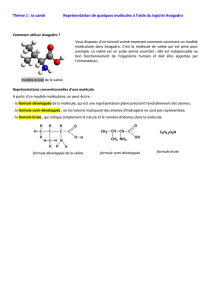
2) Caractère polaire d’une molécule
Ex 1 : le dioxyde de carbone CO2
Les deux liaisons covalentes C=O sont polarisées mais comme cette molécule est
linéaire le dipôle résultant est nul. Celle molécule est donc apolaire.
Ex 2 : l’eau H2O
Les deux liaisons covalentes O-H sont polarisées. Comme cette molécule est coudée, la
barycentre des charges positives et négatives ne coïncide pas et la molécule est polarisée.
3) Comment interpréter la cohésion des solides moléculaires ?
Ces solides sont constitués de molécules régulièrement disposées dans l’espace.
Dans le cas des molécules polaires, il existe des interactions électrostatiques entre les dipôles permanents qui
assurent la cohésion du solide, ce sont les interactions de Van der Waals.
Ex : Chlorure d’iode solide ICl
Ces interactions existent mais sont plus faibles pour les molécules apolaires.
Des interactions attractives supplémentaires peuvent s’ajouter : ce sont les liaisons hydrogène.
Ex : l’eau H2O
Une liaison hydrogène se forme entre un atome d’H lié à un atome d’oxygène très électronégatif d’une première
molécule à un atome d’oxygène O d’une seconde molécule.
Toute molécule qui possède des groupes –O-H présente des liaisons hydrogène qui renforcent la cohésion du solide
moléculaire.
Ex : Tébu(éthanol) = 78°C et Tébu(méthoxyéthane) = -25°C
car CH3-CH2-OH possède des liaisons hydrogène et pas l’isomère CH3-O-CH3
Liaisons hydrogène dans l’éthanol
Autre ex : Les polymères absorbants (polyacrylates de sodium) sont des polymères capables d’absorber plusieurs
centaines de fois leur poids en eau. Ils sont utilisés dans les couches.
C2H5O
H
HO
C2H5
COO-
COO-
COO-
COO-
COO-
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
1
/
2
100%