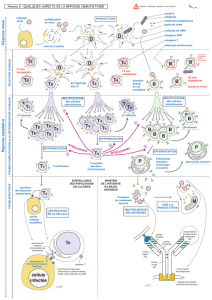
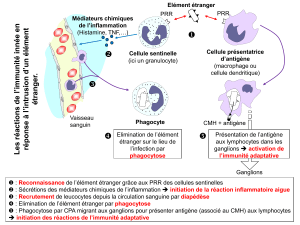
Une double sélection, positive et négative, des - iPubli

1988 ; 4:
JO vol. 4, 88

T
T
destruction
à
1
à
à
à

D
.
1
/
3
100%