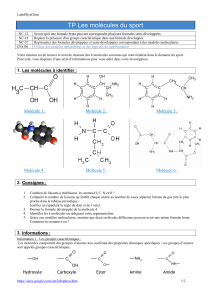
DM 05

EXERCICE CHIMIE : À LA RECHERCHE DES MOLÉCULES DE LA VIE (12 points)
Bac S Asie 2014
Document 2
Ce genre de molécules organiques avait été découvert dans la météorite
tombée près de la petite ville de Murchison en Australie en 1969.
Dans cette chondrite carbonée, les cosmochimistes de l’époque et leurs
successeurs ont dénombré plus de 70 acides aminés.
Ils y ont ainsi découvert, sous forme de traces, l'alanine, la glycine, la
valine, la leucine ? l'isoleucine, la proline, l'acide aspartique et l'acide
glutamique, molécules toutes précurseurs pour former les diverses
protéines des êtres vivants terrestres. Bien mieux, des purines et des
pyrimidines y ont également été trouvées. Or ces molécules sont les bases
azotées précurseurs de l'ADN et de l'ARN qui constituent le matériel génétique de tous les êtres vivants que porte la Terre.
Grâce à la technique de spectrométrie de masse, Philippe Schmitt-Kopplin, du Helmholtz Centre de Munich, a détecté plus de
14 000 molécules organiques différentes au sein de la célèbre météorite. Selon les chercheurs, ces analyses impliqueraient que
cette roche abriterait en réalité des millions de molécules organiques différentes. d'après http://www.futura-sciences.com/
1. En 1953, Stanley Miller a enfermé dans un ballon des gaz (méthane, ammoniac (NH3), dihydrogène et eau) et soumis le
mélange à des décharges électriques pendant sept jours.
ll a obtenu des molécules organiques, les briques du vivant, et notamment de l'urée (CON2H4), du formaldéhyde (H2CO), de
l'acide cyanhydrique (HCN) et des acides aminés.
1.1. Quel scénario des origines de la vie voulait ainsi mettre en évidence Miller ?
1.2. Miller recherchant à fabriquer des briques du vivant, justifier le choix des réactifs fait dans son expérience.
La formule générale des acides aminés est donnée ci-dessous :
1.3. Justifier le nom d'acide aminé attribué à cette molécule.
Parmi les produits obtenus dans cette expérience se trouvent l'urée et le formaldéhyde dont les formules sont données ci-
dessous :
urée formaldéhyde
1.4. Quel type de représentation a-t-on utilisé ?
1.5. On s’intéresse à la molécule d’Urée.
1.5.1. Reproduire le schéma de la molécule d'urée et représenter, en le justifiant, l’ensemble des doublets libres présents
dans cette molécule.
1.5.2. A quelle famille appartient la molécule d’urée ? Entourer le groupe fonctionnel caractéristique.
1.6. On s’intéresse au formaldéhyde.
1.6.1. Reproduire le schéma de la molécule du formaldéhyde. A quelle famille appartient la molécule ? Entourer le
groupe fonctionnel caractéristique.
1.6.2. Quel est le nom officiel du formaldéhyde ?
Document 1
L'origine des molécules prébiotiques dont l’évolution chimique aurait conduit aux polymères aujourd'hui caractéristiques de la
vie, comme les polynucléotides et les protéines, n'est pas connue. Diverses hypothèses ont été formulées. Les premières
molécules organiques auraient pu se former sur la Terre par réactions chimiques entre certains constituants de l’atmosphère
primitive dissous dans l'eau. Diverses expériences ont en effet montré la possibilité de synthèse de constituants organiques à
partir des composants de l'atmosphère primitive. Les premières molécules organiques auraient pu aussi se former au fond des
océans au niveau des sources hydrothermales où on a en effet montré expérimentalement la possibilité de synthèse de substances
organiques à partir de composés soufrés et d'oxydes de carbone. Enfin, elles auraient pu provenir de l'espace car on a identifié
divers précurseurs organiques, notamment des acides aminés, dans des météorites, comètes, etc.
acces.ens-lyon.fr/biotic/evolut/orivie/html/syn-pre.htm
R est un radical variable qui diffère d’un acide aminé à
l’autre ; il peut être soit un atome H, soit un groupe alkyl,
soit une chaîne comportant des groupes caractéristiques
divers.
NH
2
COOH
CH
R
NH
2
NH
2
O
C
H
H
O
C

2. Identification des molécules
Parmi les acides amines identifiés dans la météorite de Murchison se trouvent la Ieucine (abréviation Leu) et l`isoleucine
(abréviation Ile) dont les formules semi-développées sont données ci-dessous :
Leucine lsoleucine
2.1. On veut différencier la leucine de l’isoleucine par une technique d’identification appropriée.
2.1.1. Écrire la formule topologique de la leucine.
2.1.2. Quelle relation lie les deux molécules de Leucine et d’Isoleucine ? Soyez très précis dans votre réponse et bien
justifier.
3. On s’intéresse à la Leucine.
3.1. Reproduire la molécule de Leucine sous la forme développée sur votre copie et marquer d’un astérisque le (ou les)
carbone(s) asymétrique(s) présent(s). Vous justifierez votre réponse, en rappelant la définition d’un carbone asymétrique.
3.2. La molécule de Leucine est-elle chirale ? Justifier votre réponse.
3.3. Proposer une représentation de Cram possible de la molécule de Leucine.
3.4. A partir de votre représentation précédente, proposer un stéréoisomère de conformation. Justifier en rappelant la
définition d’un isomère de conformation.
3.5. A partir de votre représentation à la question 3.3, proposer un énantiomère.
4. On s’intéresse à l’isoleucine
4.1. Etablir la formule brute de la molécule d’isoleucine. En déduire sa masse molaire moléculaire.
Masses molaires atomiques : M(C) = 12 g.mol-1; M(H) = 1 g.mol-1; M(O) = 16 g.mol-1; M(N) = 14 g.mol-1
On a identifié dans mmétéorite = 10 g de poussière de météorite, une masse misoleucine = 1 ng d`isoleucine.
4.2 Calculer la quantité de matière d’isoleucine présente dans une masse mmétéorite = 10 g de poussière de météorite.
On a dissout cette masse misoleucine = 1 ng d’isoleucine dans 100 mL d’une solution.
4.3 En déduire la concentration molaire de cette solution.
Trop concentrée, on désire effectuer une dilution d’un facteur 100.
4.4. En déduire la concentration molaire de cette solution obtenue par dilution.
4.5. Proposer un protocole expérimental. On précisera le matériel utilisé et on expliquera succinctement les différentes étapes
de la préparation. Vous disposez de tout le matériel disponible dans un laboratoire. Le volume de la solution diluée à
préparer n’est pas imposée.
4.6. Donner une représentation possible semi-développée d’un isomère de fonction de l’isoleucine.
EXERCICE 1 PHYSIQUE : LES ONDES SISMIQUES (4 points)
Bac S Afrique Juin 2003
Lors d'un séisme, la Terre est mise en mouvement par des ondes de différentes natures, qui occasionnent des secousses plus ou
moins violentes et destructrices en surface.
On distingue:
- les ondes P, appelées aussi ondes de compression, sont des ondes longitudinales. Ce sont les plus rapides, se propageant
dans les solides et les liquides.
- les ondes S, appelées aussi ondes de cisaillement, sont des ondes transversales. Ce sont les moins rapides, ne se
propageant que dans les solides.
L'enregistrement de ces ondes par des sismographes à la surface de la Terre permet de déterminer l'épicentre du séisme (lieu de
naissance de la perturbation).
Les schémas A et B modélisent la progression des ondes sismiques dans une couche terrestre.
CH
3
NH
2
OH
O
C
CH
CH
2
CH
H
3
C
CH
3
NH
2
OH
O
C
CH
CH
CH
2
H
3
C

1. Définir une onde transversale.
2. Indiquer le schéma correspondant à chaque type d'onde.
Un séisme s'est produit à San Francisco (Californie) en 1989
Le document ci-dessous présente le sismogramme obtenu, lors de ce séisme à la station EUREKA
Le sismogramme a été enregistré à Eureka, station sismique située au nord de la Californie. L'origine du repère (t = 0 s) a été
choisie à la date du début du séisme à San Francisco.
Le sismogramme présente deux trains d'ondes repérés par A et B.
3. À quel type d'onde (S ou P) correspond chaque train ? Justifier votre réponse à l'aide du texte d'introduction.
4. Sachant que le début du séisme a été détecté à Eureka à 8 h 15 min 20 s TU (Temps Universel), déterminer l'heure TU (h ;
min ; s) à laquelle le séisme s'est déclenché à l'épicentre.
5. Sachant que les ondes P se propagent à une célérité moyenne de 10 km.s-1, calculer la distance séparant l'épicentre du
séisme de la station Eureka.
6. Calculer la célérité moyenne des ondes S.
Matériau
non déformé
Matériau
non déformé
Sens de propagation de l'onde
Sens de propa
gation de l'onde
Schéma A
Schéma B
Sismogramme : Station EUREKA

+
+
+
+
+
sol
air
nuage
d’orage
-
-
-
-
-
+
+
+
+
+
EXERCICE 2 PHYSIQUE : UN JOUR D’ORAGE (4 points)
Bac S Nouvelle Calédonie Novembre 2008
Parmi les phénomènes atmosphériques, l’éclair est le plus aveuglant et le tonnerre le plus bruyant.
Cet exercice a pour but l’étude du tonnerre
Les nuages d’orage sont des cumulonimbus, gros nuages en forme d’enclume ou
de hautes tours.
Ils sont composés à la fois d’eau et de glace.
Lors des orages, le cumulonimbus est fortement chargé électriquement.
Globalement, le sommet du nuage est chargé positivement alors que sa base est
négative.
La partie du nuage qui se trouve en regard de la Terre étant chargée
négativement, le sol se charge positivement par influence.
Par temps d’orage, on peut comparer le système {base du nuage – sol} à un gigantesque condensateur constitué par de l’air
placé entre le bas du nuage et le sol.
L’isolant entre les deux armatures est l’air; dans certaines conditions, il
devient localement conducteur. Il s’établit alors un canal ionisé entre le sol et
le nuage dans lequel une ou plusieurs décharges se produisent. Ces décharges
constituent la foudre proprement dite.
Elles se déplacent à une vitesse considérable et correspondent à une tension U
de l’ordre de 100 millions de volts et à une intensité d’environ 30 kiloampères.
L’éclair est le phénomène lumineux qui accompagne la foudre. Les gaz, sur le
trajet de la décharge électrique sont surchauffés et ionisés, ils émettent alors
de la lumière.
La contraction puis la dilatation des masses d’air surchauffé sur le trajet de l’éclair (le long du canal ionisé) créent une onde de
choc qui engendre le bruit appelé "tonnerre".
1. Donner la définition d’une onde mécanique progressive.
2. Le tonnerre est-il une onde longitudinale ou une onde transversale ? Justifier.
Dans un livre pour enfant, on peut lire : Le sais-tu?
Pendant un coup de foudre, l’éclair et le bruit du tonnerre se produisent en même temps. Mais comme la lumière va plus vite
que le son, on voit l’éclair avant d’entendre le tonnerre. Pour savoir à quelle distance se trouve l’orage, compte les secondes
entre l’éclair et le tonnerre, puis divise par trois. S’il y a six secondes, c’est que l’orage est à deux kilomètres de toi.
On considère, dans cette dernière partie, que la valeur de la célérité c de la lumière dans l’air est identique à celle dans le vide.
On prendra donc comme valeur : c = 3
108 m.s –1.
3. Montrer que la durée t qui s’écoule entre l’éclair et le tonnerre en fonction de la distance d qui sépare l’observateur de
l’orage, de la célérité du son dans l’air vson et de la célérité c de la lumière dans l’air s’écrit :
t = d (
1 1
son
v c
) .
4. Justifier le calcul proposé dans l’encadré ci-dessus permettant de connaître la distance qui sépare l’observateur de l’orage en
kilomètres. (la valeur « 3 » est arrondie pour simplifier le calcul destiné à un enfant).
+
+
+
+
+
sol
air
nuage
d’orage
-
-
-
-
-
+
+
+
+
+
canal
ionisé
1
/
4
100%