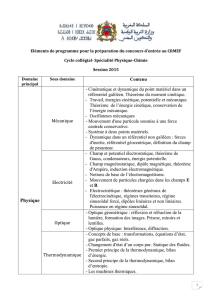
Réactions en chimie organique

Chapitre 8 :
Réactions en chimie organique
Christel ROUTABOUL
Docteur en Chimie
Chimie - Chimie organique
MED@TICE PCEM1 - Année 2006/2007
Faculté de Médecine de Grenoble - Tous droits réservés.

1 – Aspects thermodynamique et cinétique
2 – Différentes réactions organiques

1 – Aspects
thermodynamique et
cinétique
Réactifs →Produits

1.1 – Aspect thermodynamique
Bilan macroscopique
Cl
O
OH O
O
HCl
OH
O
OH O
O
H2O
Réactif minoritaire totalement consommé en fin de réaction.
Réactif minoritaire pas totalement consommé en fin de réaction.
a) Réaction totale
b) Réaction équilibrée
Exemple : synthèse d’un ester à partir d’un chlorure d’acyle
Exemple : synthèse d’un ester à partir d’un acide carboxylique (estérification)

1.1 – Aspect thermodynamique
Constante d’équilibre K
b) Réaction équilibrée
OH
O
OH O
O
H2O
Exemple
Produit des activité des produits des la réaction élevés à leur coefficient stoechiométrique divisé
par le produit des activité des réactifs élevés à leur coefficient stoechiométrique
alcool
n
uecarboxyliqacide
neau
n
ester
n
K×
×
=
Si K > 1 : la réaction se produit dans le sens prévu
Si K > 103: en général on peut considérer la réaction comme totale
Si K < 1 : la réaction se produit dans l’autre sens
Si K < 10-3 : en général on peut considérer la réaction comme n’ayant pas lieu
La constante d’équilibre ne dépend que de la température
ΔrG° = −RT ln K = ΔrH° −T ΔrS° ≈Δ
rH°
Enthalpie libre Température Enthalpie Entropie
= 4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%