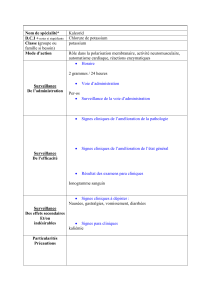
Potassium Chloride in Sodium Chloride Injection, USP

07-19-68-106
Potassium Chloride in Sodium Chloride Injection, USP
in Plastic Container
VIAFLEX Plus Container
20 mmol/L Potassium Chloride in 0.45% Sodium Chloride Injection
Electrolyte Replenisher
SUMMARY PRODUCT INFORMATION
INDICATIONS AND CLINICAL USE
Potassium Chloride in Sodium Chloride Injection, USP is indicated for:
tFluid and electrolyte replenishment
CONTRAINDICATIONS
This product is contraindicated in patients with:
tClinical conditions in which the administration of sodium, potassium, or
chloride could be detrimental
tHyperkalemia
tRenal failure or renal impairment
tConditions where potassium retention or sodium retention with edema
occurs.
WARNINGS AND PRECAUTIONS
General
Potassium Chloride in Sodium Chloride Injection, USP should be used with
great care, if at all, in patients with congestive heart failure, hyperkalemia,
severe renal insufficiency, severe renal failure, in clinical states in which
there exists edema with sodium retention, and in conditions in which
potassium retention is present.
The intravenous administration of Potassium Chloride in Sodium Chloride
Injection, USP can cause fluid and/or solute overloading resulting in dilution
of serum electrolyte concentrations, overhydration, congested states or
pulmonary edema. The risk of dilutional states is inversely proportional to
the electrolyte concentrations of the injection. The risk of solute overload
causing congested states with peripheral and pulmonary edema is directly
proportional to the electrolyte concentrations of the injection.
In patients with diminished renal function, administration of Potassium
Chloride in Sodium Chloride Injection, USP may result in sodium or
potassium retention.
Potassium salts should never be administered by IV push.
Clinical evaluation and periodic laboratory determinations are necessary to
monitor changes in fluid balance, electrolyte concentrations and acid base
balance during prolonged parenteral therapy or whenever the condition of
the patient warrants such evaluation.
For patients receiving potassium supplement at greater than maintenance
rates, frequent monitoring of serum potassium levels and serial EKGs are
recommended.
Do not administer unless solution is clear and seal is intact.
Carcinogenesis, Mutagenesis, Impairment of Fertility
Studies with Potassium Chloride in Sodium Chloride Injection, USP have
not been performed to evaluate carcinogenic potential, mutagenic potential
or effects on fertility.
Special Populations
Pregnant Women: Pregnancy Category C. Animal reproduction studies
have not been conducted with Potassium Chloride in Sodium Chloride
Injection, USP. It is also not known whether Potassium Chloride in Sodium
Chloride Injection, USP can cause fetal harm when administered to a
pregnant woman or can affect reproductive capacity. Potassium Chloride in
Sodium Chloride Injection, USP should be given to a pregnant woman only
if clearly needed.
Nursing Women: It is not known whether this drug is excreted in human
milk. Because many drugs are excreted in human milk, caution should be
exercised when Potassium Chloride in Sodium Chloride Injection, USP is
administered to a nursing mother.
Pediatrics: Safety and effectiveness of Potassium Chloride in Sodium
Chloride Injection, USP in pediatric patients have not been established
by adequate and well-controlled studies. However, the use of potassium
chloride injection in pediatric patients to treat potassium deficiency states
when oral replacement therapy is not feasible is referenced in the medical
literature.
ADVERSE REACTIONS
Adverse Drug Reaction Overview
Reactions which may occur because of the solution or the technique of
administration include febrile response, infection at the site of injection,
venous thrombosis or phlebitis extending from the site of injection,
extravasation and hypervolemia.
If an adverse reaction does occur, discontinue the infusion, evaluate the
patient, institute appropriate therapeutic countermeasures and save the
remainder of the fluid for examination if deemed necessary.
Symptoms may result from an ion excess or deficit, therefore frequent
monitoring of electrolyte levels is essential.
Reactions reported with the use of potassium-containing solutions include
nausea, vomiting, abdominal pain, and diarrhea.
Signs and symptoms of potassium intoxication include paresthesias of the
extremities, areflexia, muscular or respiratory paralysis, mental confusion,
weakness, hypotension, cardiac arrhythmias, heart block, and cardiac arrest.
Potassium-containing solutions are irritating to tissues, therefore extreme
care should be taken to avoid perivascular infiltration.
DRUG INTERACTIONS
Drug-Drug Interactions
Caution must be exercised in the administration of Potassium Chloride in
Sodium Chloride Injection, USP to patients receiving corticosteroids or
corticotrophin.
DOSAGE AND ADMINISTRATION
Recommended Dose and Dosage Adjustment
As directed by a physician. Dosage is dependent upon the age, weight
and clinical condition of the patient as well as laboratory determinations.
Frequent laboratory determinations and clinical evaluations are essential to
monitor changes in blood glucose, electrolyte concentrations, and fluid and
electrolyte balance during prolonged parenteral therapy.
Fluid administration should be based on calculated maintenance of
replacement fluid requirements for each patient. In the average adult, daily
requirements of sodium, chloride, potassium and fluids can generally be met
by the infusion of two litres of 0.45% sodium chloride solution with 20 mmol
of potassium chloride.
Administration
To avoid potassium intoxication, do not infuse solutions rapidly.
Infusion rates for the administration of potassium-containing solutions
generally should not exceed 10 mmol per hour or 120 mmol per day. The
maximum rate of infusion should not exceed 20 mmol per hour in the
absence of cardiac monitoring.
Parenteral drug products should be inspected visually for particulate matter
and discoloration prior to administration whenever solution and container
permit. Use of final filter is recommended during administration of all
parenteral solutions, where possible.
All injections in VIAFLEX Plus plastic containers are intended for intravenous
administration using sterile equipment.
Document No.: 07-19-68-106
Change No.: CP0465720
Page 1 of 4
P2 07/17/12 KLS
Confidential Property of Baxter Healthcare Corporation and its Affiliates
Route of
Administration Dosage Form/
Strength
Clinically Relevant
Nonmedicinal
Ingredients
Intravenous
Sterile Solution/
20 mmol/L potassium
chloride in 0.45% sodium
chloride
Water for injection, USP
* BAR CODE POSITION ONLY
071968106
(FRONT PAGE, right side)
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
*This artwork requires the supplier to insert a bar code(s) master(s) in the position(s) indicated. Bar code human readable
information must match human readable on spec. Bar code(s) must conform to all applicable Baxter specifications.

Additives may be incompatible. Complete information is not available.
Those additives known to be incompatible should not be used. Consult with
pharmacist, if available. If, in the informed judgement of the physician, it is
deemed advisable to introduce additives, use aseptic technique. Mix thoroughly
when additives have been introduced. Do not store solutions containing
additives.
Discard unused portion.
Directions for Use of VIAFLEX Plus Plastic Container
Warning: Do not use plastic containers in series connections. Such use could
result in air embolism due to residual air being drawn from the primary container
before administration of the fluid from the secondary container is completed.
To Open:
Tear overwrap down side at slit and remove solution container. Some opacity
of the plastic due to moisture absorption during the sterilization process may
be observed. This is normal and does not affect the solution quality or safety.
The opacity will diminish gradually. Check for minute leaks by squeezing inner
bag firmly. If leaks are found, discard solution as sterility may be impaired. If
supplemental medication is desired, follow directions below.
Preparation for Administration:
1. Suspend container from eyelet support.
2. Remove port protector from outlet port at bottom of container.
3. Attach administration set. Refer to complete directions accompanying set.
To Add Medication:
Warning: Additives may be incompatible.
To add medication before solution administration
1. Prepare medication site.
2. Using syringe with 19 to 22 gauge needle, puncture resealable medication
port and inject.
3. Mix solution and medication thoroughly. For high density medication
such as potassium chloride, squeeze ports while ports are upright and mix
thoroughly.
To add medication during solution administration
1. Close clamp on the set.
2. Prepare medication site.
3. Using syringe with 19 to 22 gauge needle, puncture resealable medication
port and inject.
4. Remove container from IV pole and/or turn to an upright position.
5. Evacuate both ports by squeezing them while container is in the upright
position.
6. Mix solution and medication thoroughly.
7. Return container to in use position and continue administration.
OVERDOSAGE
Treatment of Overdosage
In the event of a fluid or solute overload during parenteral therapy, re-evaluate the
patient’s conditions and institute appropriate corrective treatment.
In the event of an overdose with potassium-containing solutions, discontinue the
infusion immediately and institute corrective therapy to reduce serum potassium
levels as necessary.
Treatment of hyperkalemia includes the following:
1. Elimination of potassium-rich foods, medications, and IV medications
containing potassium or medication that can induce hyperkalemia.
2. Dextrose Injection, USP, 10% or 25% containing 10 units of crystalline
insulin per 20 grams of dextrose administered intravenously, 300 to 500 mL
per hour.
3. Absorption and exchange of potassium using sodium or ammonium cycle
cation exchange resin, orally and as retention enema.
4. Use of hemodialysis or peritoneal dialysis.
In treating hyperkalemia in digitalized patients, too rapid a lowering of plasma
potassium concentration can cause digitalis toxicity.
ACTION AND CLINICAL PHARMACOLOGY
Mechanism of Action
Potassium Chloride in Sodium Chloride Injection, USP has value as a source of
water and electrolytes. It is capable of inducing diuresis depending on the clinical
condition of the patient.
STORAGE AND STABILITY
Exposure of pharmaceutical products to heat should be minimized. Avoid
excessive heat. It is recommended that the product be stored at room
temperature (15oC-30oC); brief exposure up to 40oC (104oF) does not adversely
affect the product.
DOSAGE FORMS, COMPOSITION AND PACKAGING
Description
Potassium Chloride in Sodium Chloride Injection, USP is a sterile, nonpyrogenic,
solution for fluid and electrolyte replenishment in a single dose container for
intravenous administration. It contains no antimicrobial agents. Composition,
osmolarity, pH and ionic concentration are shown in Table 1.
* Normal physiologic osmolarity range is approximately 280 to 310 mOsmol/L.
Administration of substantially hypertonic solutions (>600 mOsmol/L) may cause vein
damage.
Potassium Chloride in Sodium Chloride Injection, USP in VIAFLEX Plus
Plastic Container is available as follows:
Code Size (mL) Product Name
JB1357 1000 20 mmol/L
Potassium Chloride
in 0.45% Sodium
Chloride Injection
The VIAFLEX Plus plastic container is fabricated from a specially
formulated polyvinyl chloride (PL 146 Plastic). VIAFLEX Plus on the
container indicates the presence of a drug additive in a drug vehicle.
The VIAFLEX Plus plastic container system utilizes the same container
as the VIAFLEX plastic container system. The amount of water that can
permeate from inside the container into the overwrap is insufficient to
affect the solution significantly. Solutions in contact with the plastic
container can leach out certain of its chemical components in very small
amounts within the expiration period, e.g., di-2-ethylhexyl phthalate
(DEHP), up to 5 parts per million. However, the safety of the plastic has
been confirmed in tests in animals according to USP biological tests for
plastic containers as well as by tissue culture toxicity studies.
Document No.: 07-19-68-106
Change No.: CP0465720
Page 2 of 4
P2 07/17/12 KLS
Confidential Property of Baxter Healthcare Corporation and its Affiliates
Table 1
20 mmol/L Potassium Chloride in 5.5
1000 4.5 1.5 194 77 20 97
0.45% Sodium Chloride (3.5 to 6.5)
Size (mL)
Sodium Chloride, USP
(NaCl)
Potassium Chloride, USP
(KCl)
*Osmolarity (mOsmol/L) (Calc.)
pH
Sodium
Potassium
Chloride
Composition (g/L) Ionic Concentration
(mmol/L)
Baxter Corporation
Mississauga, ON L5N 0C2
07-19-68-106
Rev. July 2012
Baxter, and Viaflex are trademarks of Baxter International Inc.
For Product Information
1-800-933-0303
(BACK PAGE, left side)
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date

Document No.: 07-19-68-106
Change No.: CP0465720
Page 3 of 4
P2 07/17/12 KLS
Confidential Property of Baxter Healthcare Corporation and its Affiliates
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT
INDICATIONS ET USAGE CLINIQUE
Le chlorure de potassium dans du chlorure de sodium injectable, USP est indiqué
pour :
tLe remplacement liquidien et électrolytique
CONTRE-INDICATIONS
Ce produit est contre-indiqué chez les patients présentant :
tDes troubles cliniques où l’administration de sodium, de potassium ou de
chlorure pourrait entraîner des effets néfastes
tUne hyperkaliémie
tUne insuffisance rénale ou une altération de la fonction rénale
tDes troubles caractérisés par une rétention de potassium ou de sodium,
accompagnée d’un œdème
MISES EN GARDE ET PRÉCAUTIONS D’EMPLOI
Généralités
Le chlorure de potassium dans du chlorure de sodium injectable, USP doit
être utilisé avec prudence, ou pas du tout, chez les patients qui souffrent
d’insuffisance cardiaque congestive, d’hyperkaliémie ou d’insuffisance rénale
grave, chez les patients dont l’état clinique est caractérisé par un œdème et une
rétention de sodium, ainsi que chez ceux présentant une rétention de potassium.
L’administration par voie intraveineuse de chlorure de potassium dans du
chlorure de sodium injectable, USP peut causer une surcharge hydrique ou
en soluté, entraînant une dilution des concentrations sériques en électrolytes,
une surhydratation, des états congestifs ou un œdème pulmonaire. Le risque
de dilution est inversement proportionnel aux concentrations en électrolytes
provenant de l’injection. Le risque de surcharge en soluté entraînant des états
congestifs ainsi qu’un œdème périphérique et pulmonaire est directement
proportionnel aux concentrations en électrolytes provenant de l’injection.
Chez les patients présentant une fonction rénale diminuée, l’administration de
chlorure de potassium dans du chlorure de sodium injectable, USP peut entraîner
une rétention de sodium ou de potassium.
Les sels de potassium ne devraient jamais être administrés par voie intraveineuse
sous pression.
Des examens cliniques et des analyses de laboratoire périodiques sont
nécessaires pour surveiller les changements du bilan hydrique, des
concentrations en électrolytes et de l’équilibre acido-basique au cours des
traitements prolongés par voie parentérale ou lorsque l’état du patient l’exige.
Chez les patients recevant des suppléments potassiques à une dose plus élevée
que la dose d’entretien, la surveillance assidue des taux de potassium sérique et
les ÉCG en série sont recommandés.
Ne pas administrer si la solution n’est pas limpide ou si le sceau n’est pas intact.
Carcinogenèse, mutagenèse et troubles de la fertilité
Des études portant sur le chlorure de potassium dans du chlorure de sodium
injectable, USP n’ont pas été effectuées pour évaluer le potentiel carcinogène, la
mutagénicité ou les effets sur la fertilité.
Groupes de population spéciaux
Grossesse : Risque de catégorie C en cas de grossesse. L’effet du chlorure
de potassium dans du chlorure de sodium injectable, USP sur la reproduction
n’a pas été étudié chez les animaux. On ignore également si le chlorure
de potassium dans du chlorure de sodium injectable, USP peut causer des
anomalies fœtales lorsqu’il est administré à une femme enceinte ou s’il peut
altérer la capacité de reproduction. Le chlorure de potassium dans du chlorure
de sodium injectable, USP ne doit être administré à une femme enceinte qu’en
cas d’indication formelle.
Allaitement : On ignore si ce médicament est excrété dans le lait maternel
humain. Comme de nombreux médicaments sont excrétés dans le lait maternel
humain, il faut administrer le chlorure de potassium dans du chlorure de sodium
injectable, USP avec prudence chez la femme qui allaite.
Enfants : L’innocuité et l’efficacité du chlorure de potassium dans du chlorure
de sodium injectable, USP n’ont pas été établies chez les enfants dans le cadre
d’études pertinentes et bien contrôlées. Cependant, l’utilisation de chlorure de
potassium injectable chez les enfants est précisée dans les ouvrages médicaux
pour le traitement de la carence potassique lorsqu’un traitement substitutif par
voie orale n’est pas possible.
RÉACTIONS INDÉSIRABLES
Présentation des réactions indésirables au médicament
Des réactions qui peuvent survenir en raison de la solution ou de la technique
d’administration comprennent les suivantes : réaction fébrile, infection au
point d’injection, thrombose veineuse ou phlébite à partir du site d’injection,
extravasation et hypervolémie.
Si une réaction indésirable survient, cesser la perfusion, évaluer le patient,
prendre des contre-mesures thérapeutiques appropriées et garder le reste du
liquide pour une éventuelle analyse, si nécessaire.
Puisque les symptômes peuvent résulter d’un excès ou d’un déficit d’ions, une
surveillance fréquente des taux d’électrolytes est essentielle.
Les réactions signalées avec l’utilisation de solutions contenant du potassium
comprennent les suivantes : nausées, vomissements, douleur abdominale et
diarrhée.
Les signes et les symptômes d’intoxication au potassium comprennent les
suivants : paresthésies des extrémités, aréflexie, paralysie musculaire ou
respiratoire, confusion mentale, faiblesse, hypotension, arythmies cardiaques,
blocage cardiaque et arrêt cardiaque.
Puisque les solutions contenant du potassium irritent les tissus, des précautions
supplémentaires doivent être prises afin d’éviter une infiltration périvasculaire.
INTERACTIONS MÉDICAMENTEUSES
Interactions avec d’autres médicaments
La prudence est de rigueur lorsque l’on administre du chlorure de potassium
dans du chlorure de sodium injectable, USP à des patients recevant des
corticostéroïdes ou des corticotrophines.
POSOLOGIE ET ADMINISTRATION
Posologie recommandée et ajustement
Tel qu’indiqué par le médecin. La posologie varie selon l’âge, le poids, l’état
clinique du patient et les résultats des analyses de laboratoire. Il est essentiel
d’effectuer fréquemment des examens cliniques et des analyses de laboratoire
pour surveiller les variations relatives à la glycémie, aux concentrations en
électrolytes et à l’équilibre hydrique et électrolytique au cours des traitements
prolongés par voie parentérale.
L’administration de liquide doit être établie en fonction des exigences relatives
au remplacement des pertes hydriques de chaque patient. Chez l’adulte moyen,
l’apport quotidien requis de sodium, de chlorure, de potassium et de liquide peut
être atteint par la perfusion de deux litres de solution de chlorure de sodium à
0,45 % avec 20 mmol de chlorure de potassium.
Administration
Afin d’éviter une intoxication au potassium, éviter la perfusion rapide de solutions.
En général, la vitesse de perfusion pour l’administration de solutions contenant
du potassium ne doit pas dépasser plus de 10 mmol par heure ou 120 mmol par
jour. La vitesse de perfusion maximale ne doit pas dépasser 20 mmol par heure
en l’absence de surveillance cardiaque.
Lorsque cela est possible (si la solution est limpide et le sac transparent), il
faut examiner les solutions médicamenteuses pour usage parentéral avant de
les utiliser, afin de déceler la présence de particules ou de coloration anormale.
L’utilisation d’un filtre final est recommandée pendant l’administration de toutes
les solutions parentérales, si possible.
Toute injection dans des récipients en plastique VIAFLEX Plus est destinée à une
administration par voie intraveineuse à l’aide de matériel stérile.
L’addition d’autres ingrédients peut être à l’origine d’incompatibilités. On ne
dispose pas de tous les renseignements. Les additifs reconnus pour causer des
incompatibilités ne doivent pas être mélangés à la solution. Si possible, consulter
un pharmacien. Si, après s’être renseigné, le médecin décide qu’il faut ajouter
des ingrédients, le mélange doit être effectué dans des conditions aseptiques.
Bien mélanger après l’injection des additifs. Ne pas conserver les solutions
contenant des additifs.
Jeter toute partie inutilisée.
Chlorure de potassium dans du chlorure de sodium injectable, USP
dans un récipient en plastique
Récipient VIAFLEX Plus
20 mmol/L de chlorure de potassium dans du chlorure de sodium à 0,45 % injectable
Recharge électrolytique
Voie d’administration Forme
pharmaceutique et
concentration
Ingrédients non
médicinaux pertinents
sur le plan clinique
Intraveineuse
Solution stérile / 20 mmol/L
de chlorure de potassium
dans du chlorure de sodium
à 0,45 %
Eau pour injection, USP
(BACK PAGE, right side)
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
VERIFICATION SIGNATURE FROM COUNTRY RA ON FILE

Document No.: 07-19-68-106
Change No.: CP0465720
Page 4 of 4
P2 07/17/12 KLS
Confidential Property of Baxter Healthcare Corporation and its Affiliates
Directives pour l’utilisation du récipient en plastique VIAFLEX Plus
Mise en garde : Ne pas utiliser les contenants en plastique raccordés en série.
Ceci pourrait en effet causer un aéroembolisme si de l’air résiduel est aspiré du
premier contenant avant que l’administration du liquide du deuxième contenant
ne soit terminée.
Pour ouvrir :
Déchirer le suremballage de haut en bas à partir de l’encoche prévue à cet effet
et enlever le sac contenant la solution. Il se peut que le plastique soit légèrement
opaque; ce phénomène est dû à l’absorption d’humidité pendant la stérilisation.
Il est normal et ne compromet pas la qualité ni l’innocuité du produit. L’opacité
diminuera peu à peu. Comprimer fermement le sac pour vérifier s’il y a des
microfuites. S’il y a des fuites, jeter la solution car la stérilité du produit peut
être altérée. Si vous souhaitez ajouter d’autres médicaments, veuillez suivre les
directives ci-dessous.
Préparation pour l’administration :
1. Suspendre le contenant au support à œillet.
2. Retirer le protecteur du site d’émergence au bas du contenant.
3. Fixer la tubulure d’administration. Consulter les directives complètes qui
accompagnent le dispositif.
Pour ajouter des médicaments :
Mise en garde : L’addition d’autres ingrédients peut être à l’origine
d’incompatibilités.
Pour ajouter des médicaments avant l’administration
de solution
1. Préparer le site d’injection.
2. En utilisant la seringue avec une aiguille de calibre 19 à 22, perforer
l’orifice d’injection refermable et injecter.
3. Bien mélanger la solution et le médicament. Pour les médicaments de
haute densité comme le chlorure de potassium, presser les orifices
lorsqu’ils sont en position verticale et bien mélanger.
Pour ajouter des médicaments durant l’administration
de solution
1. Fermer la pince du dispositif.
2. Préparer le site d’injection.
3. En utilisant la seringue avec une aiguille de calibre 19 à 22, perforer
l’orifice d’injection refermable et injecter.
4. Retirer le récipient de la tige i.v. et/ou placer le sac en position verticale.
5. Évacuer les orifices en les pressant lorsque le sac est en position
verticale.
6. Bien mélanger la solution et le médicament.
7. Remettre le récipient en position d’utilisation et continuer
l’administration.
SURDOSAGE
Traitement du surdosage
En cas de surcharge hydrique ou en soluté lors du traitement parentéral,
réévaluer l’état du patient et prendre les mesures correctives nécessaires.
En cas de surdosage chez un patient recevant des solutions contenant du
potassium, cesser immédiatement la perfusion et prendre des mesures
correctives pour réduire le taux de potassium sérique, au besoin.
Le traitement de l’hyperkaliémie comprend les éléments suivants :
1. L’élimination d’aliments et de médicaments riches en potassium, de
médicaments administrés par voie intraveineuse contenant du potassium
ou des médicaments pouvant entraîner une hyperkaliémie.
2. Dextrose à 10 % ou 25 % USP, injectable, contenant 10 unités
d’insuline cristalline par 20 g de dextrose administré par voie
intraveineuse, 300 à 500 mL par heure.
3. L’absorption et l’échange de potassium en utilisant une résine
échangeuse de cations sodium ou ammonium, par voie orale et qui agit
comme lavement de rétention.
4. L’utilisation de l’hémodialyse ou de dialyse péritonéale.
Une réduction trop rapide du taux de potassium plasmatique peut entraîner une
intoxication à la digitaline dans le traitement de l’hyperkaliémie chez les patients
digitalisés.
ACTION ET PHARMACOLOGIE CLINIQUE
Mécanisme d’action
Le chlorure de potassium dans du chlorure de sodium injectable, USP s’avère
important comme source d’eau et d’électrolytes. Il peut entraîner une diurèse
selon l’état clinique du patient.
CONSERVATION ET STABILITÉ
L’exposition des produits pharmaceutiques à la chaleur doit être minimisée.
Éviter la chaleur excessive. Il est recommandé de conserver le produit à
température ambiante (15 °C à 30 °C); une brève exposition à une température
de 40 °C (104 °F) n’a pas d’effet indésirable sur le produit.
FORMES PHARMACEUTIQUES, COMPOSITION ET CONDITIONNEMENT
Description
Le chlorure de potassium dans du chlorure de sodium injectable, USP est
une solution stérile non pyrogène administrée par voie intraveineuse pour
le remplacement liquidien et électrolytique dans un récipient unidose. Il ne
contient aucun agent antimicrobien. La composition, l’osmolarité, le pH et la
concentration ionique sont présentés dans le tableau 1.
* Les valeurs normales d’osmolarité physiologique varient entre 280 et 310 mOsmol/L.
L’administration de solutions considérablement hypertoniques (≥ 600 mOsmol/L) peut endommager
les veines.
Le chlorure de potassium dans du chlorure de sodium injectable, USP dans un
récipient en plastique VIAFLEX Plus est disponible comme suit :
Code Format (mL) Nom du produit
JB1357 1 000 20 mmol/L de chlorure de potassium dans du
chlorure de sodium à 0,45 % injectable
Le récipient en plastique VIAFLEX Plus est fabriqué à partir de polychlorure de
vinyle spécialement préparé (plastique PL 146). La mention VIAFLEX Plus sur le
récipient indique la présence d’un additif médicamenteux dans un excipient d’un
médicament. Le système de récipient en plastique VIAFLEX Plus utilise le même
récipient que le système de récipient en plastique VIAFLEX. La quantité d’eau
à l’intérieur du récipient qui peut pénétrer dans le suremballage est insuffisante
pour avoir un effet important sur la solution. Les solutions en contact avec
un récipient en plastique peuvent entraîner certains composés chimiques du
plastique comme le phtalate de di (2- éthylhexyle) (DEHP), lesquels sont présents
en très petites quantités pendant la durée de conservation (jusqu’à 5 parties
par million). Cependant, l’innocuité du plastique a été confirmée dans le cadre
d’essais sur des animaux selon des tests biologiques de l’USP et des études
effectuées sur la toxicité des cultures tissulaires.
Corporation Baxter
Mississauga, ON L5N 0C2
Baxter, et Viaflex sont des marques de commerce de Baxter International Inc.
07-19-68-106
Rév. juillet 2012
20 mmol/L de chlorure de potassium 5,5
dans du chlorure de sodium à 0,45 % 1 000 4,5 1,5 194 (3,5 à 6,5) 77 20 97
Format (mL)
Chlorure de sodium USP
(NaCl)
Chlorure de potassium
USP (KCl)
*Osmolarité (mOsmol/L) (calc.)
pH
Sodium
Potassium
Chlorure
Composition (g/L) Concentration ionique
(mmol/L)
Tableau 1
(FRONT PAGE, left side)
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
PROOFREADING INSPECTION / RELEASED ARTWORK
Proofreading Approval
________________________ ________________________ ________
Print Name Signature Date
VERIFICATION SIGNATURE FROM COUNTRY RA ON FILE
1
/
4
100%