Cinétique d`oxydation.

TD chimie Terminale Page 2 © http://physiquark.free.fr
EXERCICE 3
On veut étudier la cinétique de l'oxydation des ions iodure I- par le peroxyde d'hydrogène (eau oxygénée) H2O2. Cette réaction
est lente et totale.
1. Etude de la réaction.
On donne les couples : H2O2 /H2O et I2/I–
L'équation bilan de la réaction étudiée est : H2O2 + 2 H + + 2 I– = 2 H2O + I2
Ecrire les demi-équations correspondant aux couples oxydo-réducteurs mis en jeu.
2. Etude de la cinétique de la réaction.
On réalise le mélange ci-dessous (l'eau oxygénée est introduite à la date t = 0) :
acide sulfurique
C1 = 1.0 mol.L - 1
solution d'iodure de potassium
C2 = 1,0.10 -1 mol.L - 1
eau oxygénée
C3 = 7,8.10 - 2mol.L -1
mélange (a) V1 = 10 mL V2 = 18 mL V3 = 2,0 mL
2.1. Le mélange réactionnel brunit peu à peu. Quelle est l'espèce chimique responsable de
cette coloration ?
2.2. L'évolution de la réaction est suivie par spectrophotométrie dont le principe est décrit ci-
dessous :
Une lumière monochromatique, de longueur d'onde λ et d'intensité lumineuse Io, traverse une
cuve transparente de longueur l contenant une solution colorée de concentration c en matière
colorante.
Une partie de l'intensité lumineuse est absorbée par la solution, l'intensité lumineuse transmise It est plus faible que l'intensité
incidente Io
Ce phénomène d'absorption d'une partie de la
lumière par la solution colorée est caractérisée
par une grandeur appelée absorbance A (sans
unité).
On suit l'évolution de l'absorbance du mélange
réactionnel ci-dessus en éclairant la cuve
contenant quelques millilitres du mélange, avec
une lumière monochromatique de longueur
d'onde λ = 500 nm.
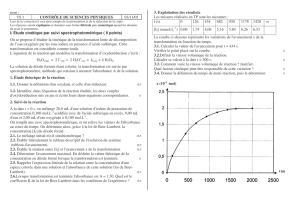
On peut ainsi tracer le graphe A = f(t)
2.2.1. Pourquoi l'absorbance augmente-t-
elle au cours du temps ?
2.2.2. Pourquoi l'absorbance est-elle
constante lorsque t est supérieur à 1000 s.
En déduire le temps de demi-réaction t½.
2.3 A partir des résultats expérimentaux, on
peut en déduire le graphe [I2] = f(t)
2.3.2. Expliquer comment on a pu obtenir le
graphe [I2] = f(t)
2.3.2. Définir la vitesse volumique
instantanée de formation du diiode à la date
t.
Déterminer graphiquement sa valeur à la
date t = 0 et à la date t½. Justifier la variation
de cette vitesse au cours du temps.
2.3.3. Calculer en mol les quantités de
matière en eau oxygénée et en ions iodure
dans le mélange réactionnel à la date t = 0.
On admettra que les ions H+ sont introduits
en excès. En déduire le réactif limitant (on
pourra s'aider d'un tableau d'avancement).
2.3.4. En déduire la concentration en diiode
formé quand la réaction est terminée.
Vérifier cette valeur sur la courbe [I2] = f(t).
La réaction est-elle terminée ?
Lumière
incidente
I0
Lumière
transmise
Solution
colorée
ℓ
t (ks)
0.2
0.4
0.6
0.8
1
A
0.2
0.4
0.6
0.8
1
1.2
t / ks
0.2
0.4
0.6
0.8
1
C (mmol/L)
1
2
3
4
5
6

TD chimie Terminale Page 3 © http://physiquark.free.fr
2.4. On recommence l'expérience avec le mélange suivant :
acide sulfurique
C1 = 1.0 mol.L-1
solution d'iodure de potassium
C2 = 1,0.10-1 mol.L-1
eau oxygénée
C3 = 7,8.10-2 mol.L-1
eau distillée
mélange (b) V1 = 10 mL V2 = 10 mL V3 = 2,0 mL 8,0 mL
2.4.1. A la date t = 0, la vitesse de formation du diiode dans le mélange (b) est-elle :
plus petite oégale oplus grande o
que la vitesse de formation du diiode dans le mélange(a) ? Justifier.
2.4.2. A la date t infinie, la concentration en diiode formé dans le mélange (b) est-elle :
plus petite oégale o plus grande o
que la concentration en diiode formé dans le mélange (a) ? Justifier.
EXERCICE 3 corrigé
1 - Etude de la réaction.
Les demi-équations pour les couples H2O2 /H2O et I2 / I - s'écrivent : H2O2 + 2 H+ + 2e– = 2 H2O
I2 + 2e– = 2 I–
2. Etude de la cinétique de la réaction.
2.1. C'est le diiode qui est responsable de la coloration de la solution (en réalité il s'agit de l'ion triodure I3
- ).
2.2.1. L'absorbance est proportionnelle à la concentration en diiode dans la solution
La concentration en diode augmente au cours du temps donc l'absorbance augmente.
2.2.2. Lorsque t est supérieur à 1000s la réaction est terminée, la concentration en diiode n'évolue plus, l'absorbance est donc
constante. Le temps de demi-réaction correspond à [I2]½ = [I2]infini /2
L’absorbance étant proportionnelle à la concentration, t½ correspond donc à Ainfini/2 soit, d’après le graphe (figure 1), t½ = 160 s.
2.3.1. On a utilisé la loi de Beer-Lambert A = k.C. Connaissant le coefficient k, on peut en déduire la courbe C = f(t).
2.3.2. La vitesse instantanée de formation du diiode à l’instant t est égale à la dérivée par rapport au temps de la concentration
molaire [I2] à cet instant :
v=d[I2]
dt
On la détermine graphiquement en déterminant le coefficient directeur de la tangente à la courbe [I2] = f(t), à la date t.
à t = 0 v0 = 2,5.10-5 mol.L-1.s-1 valeurs acceptées de 2,3.10-5 à 2,7.10-5 mol.L-1.s-1
à t1/2 v1/2 = 1,0.10-5 mol.L -1.s -1 valeurs acceptées de 0,8.10-5 à 1.2.10-5 mol.L-1.s-1
La vitesse diminue au cours du temps car la concentration des réactifs diminue au cours du temps. La concentration des réactifs
est un facteur cinétique.
2.3.3. H2O2 : n30 = C3V3 = 7,8.10-2 × 2.10-3 = 1,56.10-4 mol I– : n20 = C2V2 = 1,0.10-1 × 18.10-3 = 1,8.10-3 mol
Date Avancement H2O22 H + 2 I–= 2 H2O I2
t = 0 x = 0 n30 = 1,56.10-4 mol
t x 1,56.10-4 - x
tMxM1,56.10-4 - xM
EXCES
n30 = 1,8.10-3 mol
1,8.10-3 - 2x
1,8.10-3 - 2xM
SOLVANT
0
x
xM
Détermination du réactif limitant : s'il s'agit de H2O2 : alors 1,56.10-4 – xM = 0 soit xM = 1,56.10-4 mol
s'il s'agit de I– : alors 1,8.10-3 – 2xM = 0 soit xM = 9.10-4 mol
1,56.10-4 < 9.10-4 donc l'eau oxygénée (H2O2) est le réactif limitant.
2.3.4. A la fin de la réaction :
[I2]M=xM
V1V2V3
AN :
[I2]M=1,56.10-4
30.10-3 =5,2 .10-3 mol.L-1
D'après le graphe (figure2) [I2]final = 5,2.10-3 mol.L-1. La réaction est donc terminée puisque la concentration en diiode formé
déterminée expérimentalement est égale à celle calculée théoriquement.
2.4.1 Dans le mélange (b) : H2O2 : n30 = C3V3 = 7,8.10-2 × 2.10-3 = 1,56.10-4 mol [H2O2]0 ne change pas
I– : n20 = C2V2 = 1,0.10-1 × 10.10-3 = 1,0.10-3 mol soit
[I-]0 =1,0 .10-3
30.10-3 =3,3 .10-2 mol.L-1
[I–]0 diminue
La concentration est un facteur cinétique. La concentration initiale en ions iodure est plus faible que dans le mélange (a) donc la
vitesse de formation du diiode est plus petite.
2.4.2.
Date Avancement H2O22 H + 2 I–= 2 H2O I2
t = 0 x = 0 n30 = 1,56.10-4 mol
t x 1,56.10-4 - x
tMxM1,56.10-4 - xM
EXCES
n30 = 1,0.10-3 mol
1,0.10-3 - 2x
1,0.10-3 - 2xM
SOLVANT
0
x
xM
Détermination du réactif limitant : s'il s'agit de H2O2 : alors 1,56.10-4 – xM = 0 soit xM = 1,56.10-4 mol
s'il s'agit de I– : alors 1,0.10-3 – 2xM = 0 soit xM = 5.10-4 mol
1,56.10-4 < 5.10-4 donc le réactif limitant est toujours l'eau oxygénée
Le réactif limitant est toujours le même donc la concentration en diiode formé, à t infini, est la même.
1
/
2
100%