TS TP11 Facteurs cinétiques LPC

LaboPhysChim
https://sites.google.com/site/labophyschim/
1/1
TP11 : FACTEURS CINETIQUES
1. Observation de réactions lentes et rapides
Expérience 1 :
Expérience 2 :
Dans un tube à essai, verser 2 mL de solution de sulfate de
cuivre à 1,0.10-1 mol·L-1 puis ajouter quelques gouttes
d’hydroxyde de sodium à 1,0 mol·L-1
Observer. Noter la durée de la réaction.
Dans un tube à essai, introduire 5 mL de solution de
thiosulfate de sodium (5,0.10-1 mol·L-1) et 5 mL d’acide
chlorhydrique (1,0.10-1 mol·L-1).
Observer. Noter la durée de la réaction.
a) Faire un schéma des expériences.
b) Pourquoi peut-on dire que qu’une réaction chimique a lieu dans les expériences 1 et 2
c) Que peut-on dire de la vitesse de réaction dans ces deux expériences.
d) Proposer une définition simple de réaction lente et réaction rapide.
2. Facteurs cinétiques
Un paramètre susceptible de modifier la durée d’une transformation chimique est appelé facteur cinétique.
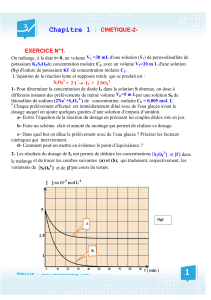
On se propose d’étudier la décomposition du thiosulfate de sodium en milieu acide.
L’équation de réaction s’écrit :
2.1. Influence de la concentration :
On place, avant le début de l’expérience, sous le bécher, une feuille de papier blanc portant une croix à l’encre noire.
On déclenche le chronomètre dès que l’on mélange la solution de thiosulfate de sodium et l’acide chlorhydrique.
On note la durée nécessaire t pour que la croix ne soit plus visible.
Expérience
Volume de solution Na2S2O3
à 5,0.10-1 mol L-1
(mL)
Volume eau distillée
(mL)
Volume de solution HCl
à 1,0.10-1 mol L-1
(mL)
1
40
0
5
2
30
10
5
3
20
20
5
a) Calculer la concentration molaire en ions thiosulfate dans chacun des béchers à la date t = 0.
b) Justifier l’ajout d’eau dans les réactifs.
c) Noter les observations de chacune des expériences et conclure.
d) Retrouver l’équation de la réaction à l’aide des 2 couples Ox/Red mis en jeu :
2.2. Influence de la température
a) A l’aide du matériel présent sur votre table, proposer un protocole détaillé permettant de mettre en évidence l’influence
de la température sur la vitesse de la réaction étudiée.
Faire valider votre protocole par le professeur, et le mettre en œuvre.
b) Noter vos résultats et conclure.
3. Rôle d’un catalyseur
La réaction étudiée est la décomposition du peroxyde d’hydrogène (eau oxygénée) H2O2, en dioxygène et eau selon l’équation :
2 H2O2(aq) 2 H2O(l) + O2(g)
Cette réaction est une réaction très lente
Dans 4 tubes à essais marqués A, B, C et D, verser environ 5 mL d’eau oxygénée à 20 volumes
Le tube à essais A servant de témoin,
introduire :
- dans le tube B : un fil de cuivre
- dans le tube C : quelques gouttes de solution de chlorure de fer III
- dans le tube D : un petit peu de pulpe de navet
a) A l’aide des observations des 4 expériences, quel est le rôle principal joué par un catalyseur.
b) Un catalyseur est entièrement régénéré et n’apparait pas dans l’équation bilan de la réaction ; laquelle de ces expériences
met en évidence cette caractéristique ?
c) Parmi les expériences précédentes, distinguer les différents types de catalyse (homogène, enzymatique, hétérogène)
d) Connaissant les couples Ox/Red de l’eau oxygénée H2O2/H2O et O2/H2O2 retrouver l’équation de la réaction.
1
/
1
100%