Nouvelles voies thérapeutiques en endocrinologie - iPubli

S
Nouvelles voies
thérapeutiques
en endocrinologie
pédiatrique
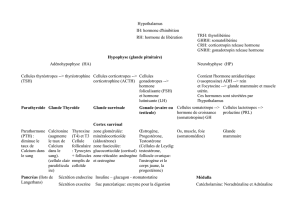
Les déficits
en hormone
de croissance
ooo,
K.

R�F�RENCES

m/s n• 6 octobre
1
/
3
100%