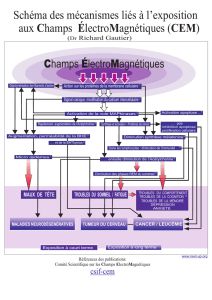
Karo Gosselin Implication des PKC dans la mort cellulaire induite
publicité

Karo Gosselin Implication des PKC dans la mort cellulaire induite via le récepteur CD40 chez les Iymphocytes B Mémoire présenté a la Faculté des études supérieures de l'université Laval pour l'obtention du grade de maître ès sciences (M. Sc.) Dipartement de Microbiologie-Tmmunologie FACULTÉDE MÉDEcINE UNMZRSITÉLAVAL AVRIL 2001 O Karo Gosselin, 2001 National Libraty Bibliothèque nationale du Canada Acquisitions and Bibliographie Services Acquisitions et services bibliographiques 395 Wellington Street Ottawa ON K1A O N 4 Canada 395. rue Wellington Onawa ON K1A ON4 Canada Your file Votre dfërtmCe Our lile Notre rëfdrence The author has granted a nonexclusive licence allowing the National Library of Canada to reproduce, loan, distribute or sell copies of this thesis in microfom7 paper or electronic formats. L'auteur a accordé une licence non exclusive permettant à la Bibliothèque nationale du Canada de reproduire, prêter, distribuer ou vendre des copies de cette thèse sous la forme de microfiche/film, de reproduction sur papier ou sur format électronique. The author retains ownership of the copyright in this thesis. Neither the thesis nor substantial extracts fiom it may be printed or othewise reproduced without the author's pedssion. L'auteur conserve la propriété du droit d'auteur qui protège cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation. Avant-propos Je voudrais tout d'abord remercier Dr. Walid Mourad pour m'avoir accueilli dans son taboratoire, ainsi que pour ses conseils tout au long de ce travail. Je tiens aussi à remercier tout ceux et celles qui sont passés dans l'équipe pendant ma maîtrise pour leurs conseils, leur soutien et leur amitié, entre autre Claire Léveillé, Farida Dandoumi, Marc-Andrd Langlois, Lahlou Hadji, Fatiha Chandad et Pierre Étongud Mayer. Merci aussi à tous ceux et ceIIes que j'ai cotoyés au CRRI. Et un gros merci tout spécialement à Guislain, pour sa compréhension, son écoute et bien plus encore durant la dernière année, et à bientôt rue du Plantin!;ox) Résumé Le CD40 est une molécule membre de la famille des récepteurs TNF jouant un rôle critique dans la médiation de la réponse immunitaire. Pendant pIusieurs années suivant la découverte de cette molécule, on a associé au CD40 surtout des fonctions positives dans la prolifération, la différenciation et la survie des cellules. Mais dans les dernières années, plusieurs travaux ont rapporté un rôle pour le CD40 dans la mort cellulaire. Chez les lymphocytes B, une corrélation a pu être établie entre la présence de I'EBV et/ou l'état d'activation des cellules et la sensibilité à l'induction de Ia mort cellulaire via CD40. Ainsi le travail présenté dans ce mémoire porte sur le rôle de l'état d'activation et Ia présence de I'EBV dans la susceptibilité à la mort cellulaire induite par le CD40 ainsi que sur la caractérisation des voies de signalisation qui sont impliquées dans cette mort. Les résultats obtenus démontrent que l'activation de cellules résistantes à la mort via le CD40 induit la susceptibiiité à cette mort, que la présence de I'EBV n'est pas nécessaire, que cette sensibilité corrèle avec la capacité du CD40 à induire une activité PKC et que les PKC sont impliqués dans cette mort. Dr. Walid Mourad (Directeur) =O Gosselin (étudianu Table des matiéres ......-...... .............................. AVANT-PROPOS ............................................................................... ............... .........................................................."".....................................IV TABLE DES MATIÈRES N- ......................................................... .. .......................-..................VII CHAPiTlU 1 INTRODUCTION......................................................................................... ................ 1 1.1. LAMOLECULE DU CD40.................................................................... ..........................................3 3 1.1.1 Découvetîe du CD40..,.......... -................................................................................................. 1.1.2 Strudure du CD40.......,........................... . . .................... .."........"..................................... 3 1.1.3 Eis>ression du CD40................................. .....-..................................................... ............... 4 1.1.3.1 Expression d u CD40 chez les lymphocytes B ......................... . ....... ....................4 1.13.2 Autres types cellulaires exprimant le CD40 .................................... .......................... 5 1.1.4 Le CDIO=un membre de lafamillle ï 3 F R ........................................................................... 5 1.1.5 Le ligand du CD40................. ........................ ..........................................5 1.1.6 Signalisaiion UltracelIrrlairevia le CD40.,.. .........................................................................6 1.1.6.1 implication des protéines tyrosines kinases.......................................... ........................7 1.1.6.2 Implication des protéines kinases C ................................................ ............................... 7 1.1.6.3 Implication des sérines/thréonines kinases ...................................................................8 1.1.6.4 Implication des molécules associées au CD40 ...............................................................8 8 1.1.6.4.1 La famille des TRAFs ................................. . 1.1.6.4.2 Autres molécules assoc~ees........................ ................................................... 11 LISTE DES ABBRÉVIATIONS " . U . . l C . . . H ................................ 12 1.1.7 Conséquences biologiques de l'engagement du CD40 ..........................................................12 1.1.7.1 Conséquences in vitro chez les lymphocytes B .............................................................12 1.1.7.2 Conséquences in vitro chez d'autres types cellulaires ...............................................14 1.1.7.3 Conséquences in vivo ........................................................................ .............................15 1.1.8 Nouveau rôle du CD40........................................................................... ..................................16 1.2. LA MORT CELLULAIRE............................................................................................................. 16 1.1.6.5 Implication d'une molécule non-associée au CD4O: le LMP-1 . 1.2.1 L'apoptose v e m IQ n P m e ........~....~.t.........m.~H...........n........................... 16 1.2.1.1 La nécrose . .....-..~..m........~....~....U...U.......UI.......U........C..........U.U...U..... 1.2.1.2 L'apoptose ..... ,.,. ..-.......-..............-.m..C.-. ....... ...r..rr.H..HI.......HI.H....17.H...U.. .......... ,,.,, ....,. ..... ......................................... 1.2.2 La mort ceUuiàire: activation. co~frôle et ext5cun'on.- ....................................... 1.2.2.2 La phase de contrôte................... .......... ......................................................... 1.2.2.2.1 La famille des protdines Bci2 .............................. . . , .................... 1.2.2.1 La phase d'activation 16 17 17 18 18 .......... ........................... ...................... 19 1.2.2.3 La phase d'exécution ................ ..........-.... ...................................................... 20 1.2.2.3.1 Les caspases... , .............. ...-.. .................................................................. 21 1.2.3 Les 64Deathreceptom" membre de lafamille ZNFR....................................... . . , ................. 22 1.2.3.1 CD95-CD95Lpas-Fas ligand)............................................................................... 23 1.2.3.2 m . 1 ...........................n........H...n....................................................................... 24 ................................................... 25 1.23.3 TRALLrRl et TRAIGR2 ........................ ..25 1.3 LECD40 ET LA MORT CELLULAIRE ........................ 1.4 E Y P O ~ E ST E OBJECTIFS DE TRAVAIL . .................. . ......*.......... 26 CHAPITRE 2 MATÉRIEL ET MÉTHODES ........................................................ ....... ........28 1.2.2.2.2 Les mitochondries . . H 3.1 DESCFUPTION DES &SULTATS .........,........... ..-...h...........H.......... ......................................32 3.1.1 L 'activairion des cellules Ramos induit leur sensibilité a la mort via le CD40..,...,........n.. 32 3.1.2 La mort cellulaire indrrite via le CD40 dans les cellules Ramos activées est dépendante .........................................................-............34 .................. PRÉSENTATION DES FIGURES .................... ............................................................................-.......37 des PKC 3.2 ................... ...................................................*..............*.................... ............ 51 BIBLIOGRAPHIE .....................................................................................................................................53 CHAPITRE 5 PERSPECTIVES Liste des figures et tableaux Figure 2: Les TRAFs sont composées de d~xérentsdomaines Ieur permetïant d'interagir entre eux et avec divers ........-..a-.-. ..-............--..-... ....-----.... .-..9 -... . récepteurs et protéines cytoplasmiques-...............................-...--a.-. Figure 3: Plusieurs molécules s'associent à la queue cytoplasmique de CD40 et permettent d'initier divers . . signaux suite a I 'engagement du récepteur. ................................................................................................................. 11 Figure 4: Rôle de l'engagement du CD40 à divers stades du développement des lymphocytes B. (inspirée de Van Kooten&Banchereau 2000).................................................................................................................................... 13 Figure 5: Lors de la présentation de l'antigène, I 'interactionCD40-CD40L est nécessaire à 1 'activation des Lymphocytes Tet des lymphocytes B(tVée de Durie et al- 1994)........................................................................ 14 Tableau 1: Les conséquencesfonctionnelles de l'engagement du CD40 à la surface de différents types 15 cellulaires................................................................................................................ ....................................... Figure 6 :Illustration des mécanismes de libération defacteurs rnitochondriaz~x(inspirée de Green et al. 1998) ...................................................................................................................................................................... 19 Figure 8: La séquence DD de certain récepteur de lafamille WFpermet le recrutement de molécules adaptrice et l'engagement de la machinerie apoptotigue (inspiré de Ashkenazi et al. 1998) ..................................................... 23 Cha~itre 3 Figure 1: L 'activationdes cellules Ramos confère un sersibilité à la mort induite via le CD4O.............................. 37 Figure 2: La mort cellulaire induite via le CD40 chez les Ramos activées est dépendante de la concentration d 'anti-CD40 .,.,......,. ........-..---....................................... ....--.---.-..... .................................. ......-.................- --..-...-..----..--.. 38 Figure 3: Cinétique de l'activation au P M nécessairepour induire la sensibilité à la mort cellulaire induite via 39 le CD40 dans les Ratnos. ............................................................................................................................................... Figure 4: L 'engagement du CD40 à la surface des Ramos activées induit Ieur apoptose.................................... 40 Figure 5: Le ligandnaturel du CD4Opeut aussi induire la mort des Ramos activées............................. 41 eee.eeeeeeee...... Figure 6: La mort cellulaire induite via le CD40 dans les Ramos activés implique les PKC. ..................... .-.-.....-... 42 Figure 7: L'activation des Ramos confire la capacité au CD40 d'induire une activité PKC. .................................. 43 Figure 8: La mort induite via le CD40 dans les Raji implique les PKC et corrèle avec la capacité d'induire une .-. acttvrte PKC............................................................................................................................................................... 43 Liste des abbréviations ADN AIF AMPc ANT Apaf ARN ARNm A~P ATP BCR c- rAP CD40L CG CPA cyto C DAG DcR1/2 DD DED DR415 EBV ERK FADD FasL GM-CSF HIGM ICAM Ig IL IP3 IRAK JNK LMP-1 acide désoxyribonucléique apoptosis inducing factor adénosine monophosphate cyclique adenine nucleotide translocator apoptotic protease activating factor- l acide ribonucléique ARN messager acide aspartique adénosine triphosphate B ce11 receptor cellular inhibitor of apoptosis protein CD40 ligand centre germinatif cellules présentatrices de i'antigène cytochrome C diacylglycérol decoy receptor 1/2 death domain death effector domain death receptor 4/5 Epstein Barr virus extracellular signal-regulated mitogen activated protein kinase Fas-associated death domain Fas ligand granulocyte macrophage-colony stimulating factor X-linked hyper IgM syndrome intercellular adhesion molecule irnmunoglobulin interleukine inositol- i ,4,5-triphosphate I L I receptor-associated kinase c-jun arnino-terminal kinase latent membrane protein 1 nerve growth factor receptor ligand lymphotoxin alpha mitogen activated protein kinase major histocompatibility complex NF-AT nuclear factor of activated T celis NEIkB nuclear factor kappa B NIK NF-kappa inducing kinase NK natural killer PI 4,542 phosphatidyiinositol-4,s-bisphosphate PI3-K phosphatidylinositol-3-kinase PKA protéine kinase A PKC protéine kinase C PLC-gamma2phospholipase C-gamma 2 PS phosphatidylsérine PTK protéine tyrosine kinase PTP protéine tyrosine phosphatase associated ICH- l/CED-3 homologous protein RAIDD RIP receptor interacting domain SAPK stress-activated protein kinase TRAF family member associated NF-kappa B activator TANK LNGFR LT-alpha MAPK MHC TBAM TGF T-celVB-ce11 activation molecule transforming growth factor TNF tumor necrosis factor TlYFR TNF receptor TRADD TNFR-associated death domain turnor necrosis factor receptor-associated factor TRAF TRAIL TNF-related apoptosis inducing ligand TRAILRlIR2 TRAL receptor 1/2 VLA-4 very late antigen-4 Chapitre 1 Introduction La réponse humorale permet la destruction des microorganismes extracellulaires et prévient la propagation des infections intracellulaires. Cette réponse humorale est médiée grâce à la sécretion d'anticorps, par les lymphocytes B, qui serviront à neutraliser les agents pathogènes et ainsi faciliteront leur destruction. L'initiation de la réponse humorale s'effectue par l'interaction d'antigènes protéiques avec les imrntmoglobulines de surface @CR, B ce11 receptor), suivi d'une intemalisation de l'antigène qui sera par la suite présenté à la surface de la cellule par les molécules du complexe majeur d'histocompatibilité (CMH) de classe II. Le complexe peptide/CMH II pourra être reconnu par les lymphocytes T CD4+ via le TCR; cette reconnaissance seniira de premier signal à l'activation des lymphocytes B et mènera aussi les lymphocytes T à sécreter et exprimer diverses molécules effectrices qui vont synergiser dans l'activation des lymphocytes B. Une de ces molécules est le ligand du CD40 (CD40L). L'interaction de cette molécule avec son récepteur, le CD40 sur les lymphocytes B, sert de deuxième signal et est une étape cruciale dans l'activation des lymphocytes B et T. En présence de cytokines cette interaction mènera à la prolifération des B de même qu'à leur différenciation en cellules sécrétrices d'anticorps. En plus de jouer un rôle dans l'immunité humorale, l'interaction du CD40 avec son ligand joue aussi un rôle dans l'immunité à médiation cellulaire puisque c e récepteur est aussi exprimé à la surface des cellules présentatrices de L'antigène telles les macrophages ou les cellules dendritiques. Dans ce contexte, L'engagement du CD40 mènera à une augmentation de la fonction présentatrice de ces cellules de même qu'à la sécrétion de diverses cytokines essentielles à cette réponse. Ainsi le CD40 est une molécule clé dans L'initiation de la réponse immunitaire et comme nous le verrons plus loin, son engagement à la surface de differents types cellulaires induit une variété de réponses surtout positives mais aussi négatives, comme la mort cellulaire. Ce phénomène en réponse à l'engagement du CD40 sera l'objet du présent travail. 1.1. La molécule du CD40 1.1.1 Découverte du CD40 La molécule du CD40 fbt découverte, presque simultanément, par deux équipes indépendantes. En 1985, Paulie et al. génère un anticorps monocIonal(S2C6) dirigé contre un nouvel antigène de SOKDa @50) exprimé entre autres à la surface des cellules B de même que sur certains carcinomes Il]; en 1986, Clark et al. identifie aussi un nouvel antigène (bp50) ayant des propriétés costimulatnces pour les lymphocytes B [2]. Ce nouvel antigène fut par la suite désigné CDw40 (Third International Workshop on leukocyte antigens, Oxford 1986) et CD40( Fourth Internationai Workshop on leukocyte antigens, Vienna 1989)[3]. 1.1.2 Structure du CD40 C'est en 1989 que 17ADNcencodant pour le CD40 est isolé à partir d'une librairie cellulaire d'expression de la lignée du lymphome de Burkitt Raji[4]. Le gène humain du CD40 se retrouve sur le chromosome 20 q11-2-q13-2 [ 5 ] tandis que son homologue murin se situe sur la région distale du chromosome 2 [q. Figure 1: Représentation schématique de la molécules du CD40 Cette protéine transmembranaire de type 1de 48-50 kDa est composée au total de 277 acides aminés (Figure 1). La partie extracellulaire compte 171 acides aminées et possède 2 sites potentiels de glycosylation 'W-linked", l'unique partie transmembranaire hydrophobe est constituée de 22 acides aminées et finalement 62 acides aminées forment la partie cytoplasmique. On compte aussi une séquence s i g d sécrétoire en N-terminal de 22 acides aminées. Le pourcentage d'homologie entre la séquence en acide aminée de la protéine chez la souris et chez l'humain est de 62% pour le domaine extracellulaire et de 78% pour le domaine extracellulaire[3 1. 1.1.3 Expression du CD40 1.1.3.1 Expression du CD40 chez les lymphocytes B Le CD40 est exprimé tôt lors du developpement des lymphocytes B; ainsi on le retrouve à la surface d'une majorité de cellules B précurseurs[7,8] [9]. Son expression persiste à travers le développement des lymphocytes B, pour finalement disparaitre au stade de plasmocyte. 11 est aussi exprimé par Ia quasi-totalité des lymphomes leucémiques B, des lymphomes de Burkitt et des lignées transformées à lYEBV[3]. Il est aussi possible d'augmenter l'expression du CD40 à la surface des lymphocytes B par l'utilisation d'activateurs polyclonaux, tek des anticorps anti-IgM, anti-CDZO, anti-Bgp95 ou par des esters de phorbolp, 61. L'interféron gamma[6] de même que IL-4[3] permettent l'augmentation du niveau d' ARN messager du CD40 sans par contre augmenter le niveau d'expression de la molécule a la surface de ces cellules. Une forme soluble du CD40, relatguée par protéolyse, se retrouve aussi de manière spontanée dans le surnageant de culture de plusieurs lignées B transformées à 1'EBV de même que dans celui de cellules B d'amygdales[l O]. L1.3.2 Autres types ceüuiaires exprimant le CD40 En plus d'être exprimé à la surface des lymphocytes B, le CD40 est exprimé à la surface de toutes les cellules présentatrices d7antigène(APC),incluant les cellules dendritiques[ll] et les monocytes/macrophages [12]. De même, des études ont aussi suggéré la présence du CD40 sur les lymphocytes T[13, 141. Parmis les cellules stromales exprimant le CD40 on compte les cellules épithéliales du thymus [15] de l'endothélium vasculaire [16, 171 les kératinocytes [18, 191 et les fibroblastes[20]. Sur certain de ces types cellulaires, le niveau d'expression constitutif du CD40 est assez faible, comme par exemple sur les monocytes et les macrophages, mais peut être augmenté par des traitements a I'interféron-gamma, au GM-CSF ou encore par diverses cytokines[l2]. 1-1.4 Le CD40: un membre de la familie TNFR L'appartenance du CD40 à la superfamille des TNFR(tumor necrosis factor receptor) est fondée par la présence dans la partie extracellulaire de la protéine, de quatre motifs homologues répétés, d'environ 40 résidus, qui sont riches en cystéine. Ce type d'arrangement particulier se retrouve aussi chez les autres membres de cette superfamille tel Fas, TNFR-1 et 2, LNGFR, OX040, CD27, CD30, etc. Bien que ces ressemblances structurales au niveau de la partie extracellulaire soient conservées chez les récepteurs membres de cette famille, la partie cytoplasmique ne présente que très peu d'homologie et on observe une très grande variabilité dans la taille de ce domaine (46 à 22 1 résidus)[21]. 1.1.5 Le ligand du CD40 Les membres de la superfamille des TNFR interagissent avec une famille de ligands apparentés 122, 231 que l'on nomme "turnor necrosis factor famiiy". Cette famille inclut le TNF alpha et beta qui lient le TNFR-1 et le TNFR-2respectivement, lYOX40-L,le CD27-L, le CD30-L, le Fas-L (CD95)etc. Le ligand du CD40 (CD40L ou gp39, TNF-related activation protein ou T-ceW-ce11 activation molecule (TBAM)) fait aussi partie de cette famille. Le CD40L est une glycoprotéine transmembranaire de type 2 de 33 à 35 kDa composée au total de 26 1 acides aminées. La partie extracellulaire comprend 215 acides aminées dont 4 sont des cystéines et comprend aussi un site de glycosylation 'N-linked", l'unique partie transmembranaire est formée de 24 acides aminées majoritairement hydrophobiques et la partie intracellulaire est constituée de 22 acides aminées. Cette molécule est principalement exprimée à la surface des lymphocytes T activés C D ~ +et CDgf; son expression a aussi été rapportée sur les basophiles, les éosinophiles, les mastocytes et les lymphocytes B activés 124, 251. Comme Ies autres protéines de la famille TNF, le CD40L est exprimé sous forme de trimère non-covalent. Par analogie à ces autres membres, l'interaction de trimères de CD40-L sur une cellule, avec son récepteur, le CD40, sur une autre cellule présente un potentiel de m u l ~ é r i s a t i o ndes molécules de CD40. D'ailleurs, cette multimérisation semble être une étape critique dans la signalisation médiée par le CD40 et différents degrés de dtirnérisation résultent en diffërentes réponses cellulaires[26,27]~ 1.1.6 Signalisation intracellulaire via le CD40 L'engagement du CD40 par son ligand naturel ou par des anticorps anti-CD40, mène à l'activation de nombreuses mol6cules de signalisation, tel des PTK, PTP, sérinekhréonine kinase et PKC(revue dans[28]). Étonnement, la partie cytoplasmique du CD40, comme celle de tous les membres de la famille TNF-R, ne contient aucun domaine kinase ni même de séquence consensus qui permettrait son interaction avec des kinases [29]. Ainsi, il a été suggéré que les signaux induits via le CD40 sont transmis grâce à des molécules associées à la partie cytoplasmique du CD40 et aussi grâce à l'activation de tyrosine kinase "non-receptor" [30-331. I.l.6.l Iqlication des protéines tyrosines kinases Plusieurs études, utilisant surtout des cellules B transformées et des cellules B normales activées, supportent 1' implication des protéines tyrosines kinases(PTK) et des protéines tyrosines phosphatases(PTP) dans la signalisation via le CD40. En effet, chez la lignée B Daudi par exemple on a rapporté la phosphorylation de Lyn, de la P13-K (phosphatidylinositol(PI)-3-kinase) et de la PLC-gamma2 (phospholipase C-gaxnma2)[34]. La PLC-gamma2 est activée suite à une phosphorylation et ceci résulte en l'hydrolyse du PI 4,s- P2 (phosphatidylinositol4,5-bisphosphate)menant a la production de diacylglycérol0AG) et d'inositol 1,4,5-triphosphate(IP3). De fait une augmentation dans le niveau de IP3 a été démontrée dans des cellules B stimulées via le CD40 1351. On a aussi observé, dans d'autres lignées EBV transformées de même que dans des cellules B d'amygdales, un changement rapide dans le patron de phosphorylation, incluant la déphosphorylation spécifique de certaines PTK tel lyn, et syk [36]. I . I.6.2 Implication des proieines kinases C Des informations contradictoires ont été rapportées concernant l'implication des PKC dans la signalisation via le CD40 chez les lymphocytes B. Ces contradictions se situent surtout autour du rôle des PKC dans l'adhésion induite par l'engagement du CD40; en effet Kansas et al.[37] ont rapporté une adhésion PKC indépendante tandis que Ren et a1.[34] ont rapporté une adhésion PKC dépendante de même que la translocation de PKC aux membranes suite à une stimulation via le CD40. Faris et al.[36,38] ont aussi observé une modification du patron de phosphorylation suite a l'engagement du CD40 en présence d'inhibiteur de PKC. Mise à part ces articles, d'autres ont rapporté que les PKC ne sont pas impliquées dans plusieurs des voies de signalisation étudiées tel l'induction de NF-kB [3 9, 401 l'induction de lymphotoxin-alpha [41] et l'activation de SAPK[42]. Des résultats contradictoires ont aussi été rapportés concernant l'implication de 1'AMPc /protéine kinase A [2 1,42,43]. 1.1.6.3 Implication des sén'nes/thréonines kinase Inui et al.[44] et Paulie et al.[45] ont rapporté la phosphorylation de plusieurs résidus sérine et thréonine dans la partie cytoplasmique du CD40. Ceci concorde avec des études décrivant une augmentation de l'activité de sérine/thréonine kinase suite à l'engagement du CD40[33]. De plus, bien que les résidus phosphorylés dans la partie cytoplasmique du CD40 ne soient pas précisément connus, on sait que ces résidus se situent dans des régions critiques pour La transmission de signaux et pour l'association de diverses protéines intracellulaires tel les TRAFs [46-481. Comme il a été rapporté, les TRAFs ont la particularité de pouvoir former des oligomères[44,49,50] et il est possible que la liaison de TRAF monoménque vs multimérique soit régulée par la phosphorylation de la queue cytoplasmique du CD40. Comme nous le verrons, B ces même TRAF qui lient le CD40, on associe l'activation d'un certain nombre de sérine/thréonine kinases en particulier la SAPWJNK et d'autres membres de la famille des MAPK[39, 51, 521. 1.1. 6.4 Implication des d é c u l e s associées au CD40 1.1.6.4.1 La famille des T U F S Lors des dix dernières années, l'identification d'une nouvelle famille de molécules s'associant au niveau intracellulaire à différent membre de la famille TNFR, a permis d'éclaircir certaines voies de signalisation propres à l'engagement de ces récepteurs dont le CD40. Cette famille de protéines que l'on nomme TRAF (revue dans [53])( Tumor Necrosis factor ReceptorAssociated Factor) est composée à ce jour de 6 membres, soit T M 1 à T W 6 . Chaque molécule TRAF peut être divisée en plusieurs sous-domaines ayant chacun un rôle particulier (Figure 2); parmis ces domaines, un seul est homologue à tous les TRAF et on le nomme domaine TRAF. Ce domaine comprend une partie C-terminale qui interagit avec la partie cytoplasmique des récepteurs et d'autre molécules tel NF-kappa inducing kinase(N1K); la partie N-terminal du domaine TRAF est responsable des interactions avec plusieurs molécuies régulatrices. En effet les TRAFs interagissent avec différentes protéines cytoplasmiques: RIP2(receptor-interacting protein 2) s' associe avec les TRAF 1, 5 et 6, TANK(TRAF family member-associated NF-kappaB activator), TRADD(TNF-RI-associated death-domain protein), c-IAP l (cellular inhibitor of apoptosis protein), c-IAP2, Casper et A20 lient le TRAF2, IRAK (IL-1 receptor-associated kinase) lie le TRAF6. Ce domaine N-terminal permet aussi aux différents TRAFs d'interagir entre eux pour former des homooligomères et des hétérooligomères. Tous les TRAFs, iil'exception de TRAFl comportent plusieurs motifs "zinc fmger" et un motif fmger"; ces motifs structuraux représentent des sites de liaisons permettant différentes interactions de type protéine-protéine ou protéine-ADN. motif motif "ring finger" "zinc finger" domaine TRAF-N domaine TRAF-C Figure 2: Les T W s sont composées de différents domaines leur permettant d'interagir entre eux et avec divers récepteurs et protkines cytoplasmiques. Parmis les TRAFs qui se lient directement au CD40 (revue dans [28]) on compte le TRAF 1, TRAF2, TRAF3 et TRAF6. Le site de liaison pour Le TRAF1, TRAFZ et T M 3 a été ciblé à la séquence ~SOPVQET, soit à proximité de la thréonine234, que l'on a décrit comme un résidu critique dans la transmission de signaux via le CD40[44]. Le TRAF6 pour sa part se lie à une région plus près de la membrane plasmique correspondant à la séquence ~~OQEPQEINF.Un autre TRAF se lie au CD40 mais de manière indirecte via le TRAF3, il s'agit de TRAF5[54]. De plus, une étude récente suggère un rôle pour le degré de multimérisation des récepteurs du CD40 dans l'affmité des TRAFs pour ce récepteur de même que pour la sélectivité du recrutement des TRAFs à la queue cytoplasmique du CD40[26]. Les TRAFs ont une implication certaine et un rôle important à jouer dans la signalisation induite via le CD40 (Figure 3). Mais l'exclusivité de voie qui serait propre à chacun des TRAF qui Iient le CD40 dans sa partie cytoplasmique n'a pu être établie, on observe plutôt une certaine redondance. De plus, la contribution de chaque TRAF à l'activation commune de certaines molécules de signalisation n'est pas très claire. Pullen et al.[55] rapportent que l'activation de NF-kappa et J N K nécessite les deux régions cytoplasmiques du CD40 qui lient les TRAF et l'activation de p38MAPK dépend plutôt de TRAF6, tandis que Sutherland et d.[56] qui avaient précédemment démontré l'activation de JNK,p38MAPK et W K A P kinase-2 [Sllsuite à l'engagement du CD40, rapportent que la région du CD40 qui lie les TRAF-2,-3 et -5 est importante pour l'activation de NF-kappaB, JNK, p38MAPK de même que pour l'induction de la phosphorylation de IkappaB alpha et sa dégradation. Un rôle pour le TRAF2 dans la recombinaison isotypique a été rapportéC571. Ce TRAF semble critique pour l'activation de NF-kappa B et l'induction du gène de ICAM-1 via IkappaBalpha, et l'activation de SAPK[58]. Le TRAF3 pour sa part semble jouer un rôle dans l'activation de p38 et le contrôle de la sécretion d'immunoglobulines puisque ces fonctions ont été inhibées par 17utiIisationd'un dominant n é g a t i f w du TRAF3. Par contre, dans ce même travail, on démontre que ce DN ne bloque que partiellement l'activation de JNK, la sécretion d'IL-10, de LT alpha et TNF alpha[59]. Des formes mutées de TRAF3 et TRAFS ont permis de démontrer un rôle pour ces molécules dans l'induction par le CD40, de l'expression du CD231601. Finalement le TRAF6 semble important pour l'induction de la sécrétion d'IL-6 et d'immunoglobuliiies via le CD40. On rapporte aussi que le CD40 via TRAF6 recrute NIK(NF kappa B inducing kinase) et active NFkappaB de même que le promoteur Cepsilon par une voie impliquant IKK-1AK.K-2. Une autre équipe démontre aussi que le CD40 active ERK via une voie Ras dépendante et indépendante dans laquelle TRAF6 pourrait être impliqué[6 11. 1.1.6.4.2 Autres molécules associées En plus des TRAFs, l'association de la molécule janus kinase 3 (Jak3) a aussi été rapportée comme étant constitutive chez les lymphocytes B [62]. Des observations contradictoires ont été rapportées quant ii son rôle dans l'induction de certaines molécules de surface (ICAM-1, CD23, lymphotoxin alpha) suite à l'engagement du CD40[58, 631. Récemment, Morio et al.[64] ont démontré l'association du CD40 à Ku, une protéine nécessaire à la commutation isotypique; ils rapportent que l'engagement du CD40 conduit à la translocation de Ku, du cytoplasme au noyau, suivi d'une augmentation de l'activité de protéine kinase ADNdépendante. + %pK kinase ADN-dépendante + p38MAPK c-jun, ATF-2, NF-kB inductioi de gènes (?) Figure 3: Plusieurs molécules s'associent à la queue cytoplasmique de CD40 et permettent d'initier divers signaux suite A l'engagement du récepteur. 1.1.6.5 Implication d'une ~~~)I&cule non-(~ssociéeau C.40: le L W - L Une autre molécule non-associée au CD40 semble avoir une influence considérable sur les signaux qui sont médiés via ce récepteur dans certains types cellulaires. Cette molécule que l'on nomme LMP-l(Latent Membrane Protein 1)est une protéine intégrale membranaire codée par I'EBV (Epstein Barr virus); l'initiation de signaux intracellulaires médiés par cette molécule résulte de son auto-aggrégationL651 et son expression confere aux cellules qui l'expriment un phénotype de cellule activée (haut niveau d'expression des molécules d'adhésion et des molécules costirnulatrices, activation de NF-kappa B et c-jun kinase). En plus de partager certaine des même fonctions effectrices, le LMP-1 et le CD40 ont en commun de lier certain des même TRAFs(TRAF1, TRAF2, TRAF3 et TRAFS). Ainsi, l'interaction du LMP-1 avec les TRAFs peut modifier Ie répertoire de TRAFs disponibles, et de cette façon altérer les voies de signalisation induites suite à l'engagement du CD40. 1.1.7 Conséquences biologiques de l'engagement du CD40 1.1.7.1 Conséquences in vifro chez les lymphocytes B Le CD40 est exprimé tôt lors du développement des lymphocytes B et persiste tout au long de leur maturation; plusieurs études in vitro ont permis de démontrer l'effet de l'engagement du CD40 à divers stades de cette maturation de même que son rôle dans ce processus (figure 4). Chez les cellules B au repos, l'engagement du CD40 mène a leur activation ce qui se traduit par une augmentation de la taille de ces cellules de même que l'augmentation du niveau d'expression de certaines molécules tel le CD23, VLA-4(Very Late Antigen), CD80, CD86. Chez ces cellules, l'engagement simultané du CD40 et du BCR induit un phénotype caractéristique des cellules germinales. Chez les cellules des centres germinatifs(CG), une stimulation prolongée via le CD40 va induire une différenciation en cellule mémoire tandis que l'interruption de cette stimulation va permettre leur différenciation en plasmocyte [66-681. Un autre rôle propre au CD40 est la survie des cellules des centres germinatifs et de certaines lignées cellulaires suite à une stimulation via le BCR [69, 701. Ce phénomène semble être partiellement médié par l'induction de gènes régulateurs de l'apoptose fesant parti de la famille Bcl[71,721. Les cellules B activées via le CD40 vont entrer dans un état de prolifération qui pourra être soutenu par l'ajout de certaines cytokines tel L-4,IL- 13,l'IL-10 ou la combinaison de cellesci 131. Ces cytokines peuvent aussi induire la production d'immunoglobulines chez les cellules stimulées via le CD40. L'IL-IO induit une commutation vers la production d'IgG1 et IgG3 [73] et en combinaison avec le TGF-beta (Transforming Growth Factor) il induit la production d' IgA. L'IL-4 ou l'IL- 13 va aussi induire une commutation qui se traduira par une production d'IgG4 et d'IgE. A /6 stimulation prolongée via le CD40 prolifération expression de CD23 prolifération différenciation expression de Fas expression de CD80lCD86 précurseurs CG B memoire prolÏf6ration différenciation commutation isotypique sélection développement de B mémoire production d'lg production d'IL-6 Figure 4: Rôle de l'engagement du CD40 à divers stades du développement des lymphocytes B(inspirée de Van KootenManchereau 2000). Parmis les autres réponses biologiques in vitro induites via le CD40 dans les lymphocytes B on compte l'induction de diverses cytokines comme IL-6, TNF-alpha, LT-alpha et l'IL-1 O. En plus d'être indispensables dans la réponse humorale par la production d'anticorps, les lymphocytes B sont aussi des cellules présentatrices dyantigénes(CPA), tout comme les monocytes, macrophages, cellules dendritiques. Dans ce contexte, l'interaction CD40-CD40L sert de second signal suite à la reconnaissance du complexe antigène/MHC par le TCR. Ce signal est crucial a l'activation des lymphocytes T et des CPA (figure 5). I activé + activé + anergique ir non-activé Figure 5: Lors de la présentation de l'antigène, l'interaction CD4O-CD40L est nécessaire à l'activation des lymphocytes T et des lymphocytes B(tirPe de Durie et al,1994) 1.1.7.2 Conséquences in vitro chez d'autres Wpes cellulaires Bien que l'on ait tout d'abord cru que l'expression du CD40 était limitée aux lymphocytes B, différentes études ont par la suite démontré son expression à la surface de différent types cellulaires, de même que diverses conséquences biologiques suite à son engagement sur ces cellules(revue dans [741). suivant: Ces conséquences fonctionnelles sont résumées dans le tableau Tableau 1: Les cons4quences fonctionnelles de I'engagement du CD40 B la surface de différents types cellulaires. Type c d1ula i r e conaëquence fond onnelle cellules endoth6liales stimule l'expression de CD62E. CD106 e t CD54 augmente l a production de IL-1, IL-8, 11-8 macrophagesimonocytes sécrétion de cytokine production de NO production de métatloprotéinase sunrie cellules dendritiques croissance et suruic expression de mol4cules CO-stimulatrice augmente la production de cytokine cellules &pithéliales augmente la production de cytokinekhemokine inhibition de la croissancelapoptose fibroblastes induction de la prolif6ration augmente la production de cytokine 1.1.7.3 Co~~séquences in vivo L'importance de l'interaction du CD40 avec son ligand le CD40L est venu de par la découverte de la cause du syndrome HIGM (X-linked hyper IgM syndrome). La cause du syndrome est liée à des altérations génétiques (mutation ou délétion) du CD40L qui ne permettent pas une expression normale de la molécule[75]. Ce syndrome se caractérise par un faible niveau ou une absence d'IgG, d'IgA et d'IgE sérique, des défectuosités des centres germinatifs de même que des défectuosités dans la formation de cellules B mémoires[2 1, 76, 771. Cette découverte a ainsi permis de mettre en évidence un rôle pour l'interaction CD40CD40L dans l'immunité humorale. De plus chez ces patients, on observe aussi une certaine susceptibilité à différentes infections opportunistes ce qui suggère un r6le pour l'interaction CD40-CD40L dans la réponse immunitaire à médiation cellulaire[78-801. L'utilisation d'anticorps bloquants dirigés contre le CD40L de même que des knockouts du CD40 ou CD40L dans divers modèles murins de maladies a pennis de démontrer l'importance de cette interaction dans les maladies autoimmunes[8 1-83], les infections causées par différents microorganismes et dans la tolérance lors de transplantation[84,85]. 1.1.8 Nouveau rôle du CD40 Comme nous venons de le voir, au CD40 on a souvent associé des rôles plutôt positifs de par les conséquences de son engagement sur différents types cellulaires. Mais depuis quelques années, plusieurs études ont permis de mettre en évidence que comme d'autres récepteurs de la famille TNFR, le CD40 joue aussi un rôle dans la mort cellulaire. Ainsi la prochaine section portera sur la description de ce phénomène d'une importance majeur dans le maintien de l'homéostasie en général et sur les observations qui ont été rapportées concernant la mort induite via le CD40. 1.2. La mort cellulaire L'équilibre entre la prolifération et la mort cellulaire régit le développement harmonieux et la survie des organismes pluricellulaires. L'apoptose et la nécrose sont deux formes de mort cellulaires intervenant de manière générale dans des contextes différents. Mais les même stimuli peuvent à la fois induire une mort cellulaire de type apoptotique ou nécrotique; de plus, les molécules et les voies de signalisation impliquées sont parfois les mêmes. Ainsi la distinction reste surtout au niveau morphologique de la cellule et des conséquences sur l'environnement de celle-ci(revue dans 186, 871). 1.2.1 L'apoptose versus la nécrose 1.2.1.1 La nécrose Le terme nécrose désigne surtout un processus de mort cellulaire accidentel et incontrôlé prenant place suite à une condition pathologique majeure et aiguë tel l'hypoxie, l'hyperthermie, l'infection virale, l'exposition à diverses toxines exogènes, l'attaque du complément, etc. Ce processus résulte en un gonflement des mitochondries puis à leur défaillance, suivi d'un gonflement de la cellule, de dysfonctionnement de la membrane plasmique et fmalement de la rupture de cette membrane. Les changements au niveau du noyau ne sont pas considérables. La perte d'intégrité de la membrane plasmique entraîne la libération du contenu de la cellule. Ainsi différentes composantes cellulaires tels des lysosymes et des protéases se retrouvent dans le milieu ce qui déclenche une réponse antiinflammatoire provoquée par la libération de cytokines par des macrophages enviromants[86, 871- 1.2.1.2 L 'apoptose L'apoptose est un processus biologique normal ayant un rôle central dans le développement, le fonctionnement et le maintien de i'homéostasie du système immunitaire et du renouvellement cellulaire en général. Les signes morphologiques caractéristiques de l'apoptose comprennent la condensation de la membrane plasmique et nucléaire, la condensation de la chromatine, perturbation de la structure du cytosquelette, fragmentation de l'ADN, exposition des phosphatidyles sérïnes, une contraction de la cellule suivi de la formation de corps apoptotiques. Contrairement à la nécrose, l'apoptose est un processus de mort cellulaire plus "silencieux'~ qui n'initie pas de réponse inflammatoire puisque la formation de corps apoptotiques empêche la libération du contenu de la cellule. Comme pour la nécrose, les macrophages et autres phagocytes viendront ingérer ces restes cellulaires[86,87]. 1.2.2 La mort cellulaire: activation, contrôle et exécution. 1.2.2.1 La phase d'activation La mort cellulaire peut être déclenchée par différents signaux intra ou extra-cellulaires de nature physiologique ou pathologique. Ainsi l'activation de ce processus peut être causée par une carence en facteur de croissance, par l'engagement de certains récepteurs membranaires (TNFR, Fas, T'AIL-RI/R2) ou nucléaires (glucocorticoïdes), par des dommages à l'ADN ou aux organelles (radiation, agent cytotoxique, hyperthermie), par L'entrée dans la cellule d'enzymes protéolytiques (granzyme). 1.2.2.2 La phase de contrôle La décision d ' d e r vers la mort, la survie, la prolifération ou la différenciation dépendra entre autres du génotype et de l'état de la cellule. Plusieurs molécules intracellulaires qui selon le contexte, ont des propriétés pro etfou anti-apoptotiques, interviendront dans cette phase de contrôle de la mort cellulaire. 1.2.2.2.1 La famille des protéines BcZ2 La famille de protéines Bcl-2 joue un rôle majeur dans la régulation de l'apoptose(revue dans[88-901. Parmis les 16 membres de cette famille certains agissent comme inhibiteur de l'apotose, tel Bcl-2, Bcl-x~,Bcl-wet d'autre comme promoteur de I'apoptose, tel Bax, Bak, Bik et Bid. Les membres pro-apoptotiques et anti-apoptotiques ont la capacité de former des homo ou des hétérodimères; la proportion de ces dimères semble déterminante dans la sensibilité d'une cellule à la mort. Par exemple, une surexpression de Bax favorise la formation d'homodimère de cette protéine et sensibilise à la mort; à l'inverse un signal de survie induisant BcI-2 favorisera des hétérodimères BadBcl-2. Certain membre de cette famille, tel Bcl-2, réside dans le cytoplasme, lié à la membrane des mitochondries, du réticulum endoplasmique et du noyau. On croit que leur présence sert à enregistrer des dommages qui pourraient être causés à ces membranes et ainsi pourraient modifier leurs comportements au niveau du transport d'ions ou de petites molécules. Certaines évidences suggèrent que les membres anti-apoptotiques de cette famille de protéines agissent en inhibant l'action ou la libération d'activateur de caspases, tel le cytochrome C; d'autre tel Bax, suivant un signal apoptotique, semble agirent de manière contraire en se fixant a la membrane externe des mitochondries formant des canaux spécinques qui permettent la Libération de facteurs activateurs ou pro-apoptotiques. 1.2.2.2.2 Les mitochondries Outre le rôle des mitochondries dans le métabolisme et le maintient de l'homéostasie cellulaire, depuis quelques années certaines études ont démontré un rôle pour cet organelle dans le processus de mort cellulaire (revue dans[9l, 921. Les mitochondries agissent au niveau du contrôle de part la présence des membres de la familles Bcl-2 sur leur membrane et aussi au niveau de l'initiation de l'exécution par la libération de différents facteurs activant les caspases tel le cytochrome c et le AIF(Apoptosis Inducing Factor). Deux mécanismes expliquant la libération de tels facteurs ont été proposés (Figure 6). + stimuli apoptotique + cyto C, AIF, autres facteurs - altération potentiel redox - catastrophe bioénergétique x* + activation caspase 1 mort cellulaire Figure 6 : Illustration des mécanismes de libération de facteurs mitochondriaux (inspirée de Green et al. 1998). Tout d'abord, dans plusieurs processus apoptotiques une forte corrélation a été établie entre la chute du potentiel de la membrane interne des mitochondries et la formation de mégapores (permeability transition pores (PT pores)) . Celles-ci sont très peu caractérisées mais semble être constituées de plusieurs protéines de la membranes interne (ANT, adenine nucleotide translocator) et externe (porine) qui collaborent entre elles pour former un large canal permettant le passage de diverses molécules. Ainsi l'ouverture de ces mégapores mènent à une dissipation du gradient H+, un découplage de la chaîne respiratoire, un gonflement osmotique et finalement une rupture de la membrane externe du mitochondrie puisque la surface de la membrane interne lorsque dépliée est supérieur à celle de la membrane externe. Cette rupture permet la libération de molécules intermembranaires tel le cytochrome c et l ' N F mais aussi de radicaux libres, de ~ a 2 +et inhibe la chaîne respiratoire et provoque une dépletion de 1'ATP [91,921. Une deuxième théorie implique la formation, par des protéines particulières, de canaux spécifiques dans la membrane externe qui permettrait la libération de ces activateurs de caspase. Et de fait plusieurs membres de la famille Bcl-2 ont la capacité de part la présence d'un domaine particulier dans leur structure, de former des pores. 11 a déjà été rapporté que la présence de Bcl-2 pouvait inhiber le relarguage du cytochrome c et que la présence de Bax pouvait induire ce relarguage[91, 921. Le fait que des études ont démontré qu'une libération du cyto c peut précéder la chute du potentiel membranaire favorise le deuxième modèle et suggère qu'un mécanisme de "feedback" impliquant dans un premier temps la libération de cytochrome c, suivi d'une activation des caspases qui suite à leur action protéolytique induirait la formation de mégapores[91,921. Ainsi, une fois la décision prise, la cellule s'engage irréversiblement dans la phase d'exécution de la mort celluIaire, c'est-à-dire le démantèlement de la cellule, par l'activation de molécules effectrices telle les caspases . 1.2.2.3.1 Les caspuses Les caspases sont des cystéines protéases jouant un rôle dans l'apoptose(revue dans[93-97), dans l'inflammation et plus récemment des études ont démontré un rôle pou. les caspases dans la prolifération des lymphocytes T[98]. Les 13 membres de cette famille possèdent une similarité au niveau de leur séquence en acides aminées, de même qu'au niveau de leur structure et de la spécificité de leur substrat. Chaque caspase exprimée tout d'abord sous une forme inactive fiymogène ou proenzyme) est constituée d'une longue et d'une courte sous-unité. L'acquisition de la forme active consiste en un clivage au niveau de résidu aspartate de part et d'autre de la longue sous-unité permettant son association avec la courte sous-unité, menant ainsi à la formation d'un hétérodimère protéolytiquement actif. L'activation séquentielle des caspases s'effectue dans une cascade ressemblant à celle du complément, où une caspase activée peut en activer une autre en la clivant et ainsi de suite. longue sous-unite prodomaine A Asp 1 f Asp courte sous-unité A , enzyme active Figure 7: Activation des caspases En se basant sur la structure primaire des caspases, il est possible de les classer en deux groupes; le groupe 1 comprend la caspase-2, -8, -9, et -10 et le groupe II Les caspases-3, -6, -7. En plus des deux sous-unités, les caspases du groupe 1possèdent un long pro-domaine aminoterminal qui contient des motifs spécifiques des interactions protéines-protéines. Ainsi ce domaine va permettre à ces caspases d'interagir avec des mol6cules adaptrices (pe. FADD) qui elles interagissent avec la partie cytoplasmique de récepteurs membranaires ou avec des co-facteurs (Apaf-1). Cette association aura pour but de permettre une action autoprotéolytique soit par un rapprochement de deux ou plusieurs caspases permettant une action entre les caspases, soit par un changement de conformation ou par la dissociation d'un inhibiteur. Les caspases du groupe II ne possèdent pas ce domaine, ou il est trop court pour permettent une telle action; elles seront activées par l'action des caspases du groupe 1. Ainsi les caspases du groupe I portent aussi le nom de caspases initiatrices ou activatrices et celle du groupe II le nom de caspases effectrices puisqu'elles sont les principales responsable de la protéolyse des substrats spécifiques. Les caspases agissent toutes en clivant leur substrat après un résidu aspartate mais nécessite aussi une séquence de reconnaissance de quatre acides aminées située en NH2-terminal du site de clivage. Cette séquence de reconnaissance est variable et permet entre autre de classer les différentes caspases en sous groupes. On dénombre une soixantaine de substrat des caspases; le clivage de certain de ces substrats mènera à leur activation tandis que d'autres seront désactivés par cette même action ce qui aura diverses conséquences. Parmis ces conséquences on compte un arrêt du cycle cellulaire, un démentelement des mécanismes de réparation (de l'ADN), un désassemblage des structures moléculaires, un détachement des cellules et un étiquetage (PS-phosphatidyle sérine) des cellules apoptotiques afin de permettre leur élimination par les phagocytes. 1.2.3 Les "Death receptors" membre de la famille TNFR Certain récepteur membre de la famille TNFR, portent en leur domaine cytoplasmique, un domaine homologue de 80 acides aminées que l'on nomme "death domain" P D ) . Ce domaine est impliqué dans la transmission de signaux induisant la prolifération, mais surtout il a la particularité de pouvoir provoquer l'engagement de la machinerie apoptotique par le recrutement de diverses protéines cytoplasmiques qui contiennent un motif DD similaire(revue dans [99]). Le Fas, le TNFRl et le TRAIL sont parmi les "death receptors" les plus connus. Ainsi les mécanismes d'induction de la mort via ces trois récepteurs feront l'objet de la présente section. TNF ,-. . - .. .. \. - .. CD95L - -.- caspase-8 hi^ -1% (inactive: .-.- . IC caspase-8 a + i I caspases e ectrices NF-KB/JNK mort cellulaire c-j n t v mort cellulaire Figure 8: La séquence DD de certain récepteur de la famille TNF permet le recrutement de molécules adaptrice et l'engagement de la machinerie apoptotique (inspiré de Ashkenazi et al. 1998) 1.2.3.1 CD95-CD95L (Fm-Fasligand) Le Fas est exprimé à la surface d'une grande variété de cellules comme les cellules lymphoïdes, les hépatocytes, certaines cellules tumorales, etc. L'expression du FasL, son ligand, se restreint surtout aux lymphocytes T cytotoxiques et aux cellules NK. Le ligand du Fas de part son expression sous forme de trimère non covalent, a la capacité de multimériser son récepteur tout comme les autres membres de la famille TNF. Ainsi l'engagement du CD95 mène à l'aggrégation des "death domain" qu'il possède dans sa partie cytoplasmique. Suivant cette agrégation, une protéine adaptrice que l'on nomme FADD (Fas-Associated Death Domain) vient se lier à L'aggrégation de "death domain" via son propre "death domain". En plus, la protéine FADD comporte un autre domaine que l'on nomme "death effector domain" qui va permettre sa liaison à un domaine homologue se situant sur la forme non active de la caspase-8 (zymogène). Cette liaison entraînant une oligomérisation des zymogènes de caspase-8, va permettre leur activation via un mécanisme d'autoclivage et conséquemment une activation de caspases effectrices se situant en aval, tel la caspase-9. L'apoptose induite via ce récepteur est un processus important dans l'élimination de cellules T activées suivant une réponse immune, la délétion de cellules infectées par un virus, l'élimination de cellules cancéreuses et la destruction de cellules lors de diverses pathologies(revue dans[100, 1011. Bien que cette voie apoptotique soit présente et fonctionnelle, contrairement au Fas le TNF n'induit la mort que très rarement et le plus souvent en présence d'inhibiteur de synthèse protéique. Ce phénomène suggère l'existence de facteur cellulaire qui ont la capacité de bloquer la voie apoptotique induite par TNF. Comme le Fas, l'engagement du TNF avec son récepteur induit l'aggrégation des DD au niveau cytoplasmique du TNFRI. Mais cette aggrégation ne mène pas à la liaison directe du FADD avec les DD; une autre protéine adaptrice que l'on nomme TRADD (TNFR-Associated Death Domain)viendra tout d'abord se fixer via son propre DD. Contrairement au FADD, TRADD ne possède pas de "death effector domain" mais elle possède un site de liaison qui pourra être reconnu soit par RIP (ReceptorInteracting Protein) ou par FADD. RIP s'associe aussi à TRAF2 et ainsi cette association stimule la voie menant à l'activation de NF-kappaB et celle de JNKIAP-1. L'association de FADD pour sa part, active la voie apoptotique via la caspase-8. Une autre voie apoptotique peut être activée via le TNFR-1, elle passe par la liaison de RAIDD (CRADD) une autre protéine adaptrice, au DD de RIP et mène à l'activation de la caspase-2(revue dans[102,103]). 1.2.3.3 TRAIL-RI et TRAIER2 Le système du TRAIL et ses récepteurs est plus récemment venu s'ajouter à la liste grandissante des "death receptor". Ce système possède plusieurs particularités qui le distinguent des autres systémes. Tout d'abord le TRAIL induit l'apoptose seulement dans les cellules tumorales ou transformées et n'affecte pas les cellules normales; ensuite on retrouve les ARNm du TRAIL de manière constitutive dans un grand nombre de tissus, contrairement à plusieurs autres membres de la famille TNF dont l'expression transitoire est fortement régulée. Le TRAIL possède en tout 4 récepteurs, dont deux (TRAIL-RI ou DR4 et TiUUL-R2 OU DR5) présentent un DD dans leur partie cytoplasmique et deux autres (T'RAIL-R.3 ou DcRl et TRAIL-R4 ou DcR2) qui semblent agirent à titre de leurre, empêchant la liaison du TRAlL avec le DR4 et le DR5 et ainsi offkant une forme de protection contre la mort induite via cette molécule. L'induction de la mort via le TRAIL est un processus qui nécessite une activité caspase, mais l'association de protéine adaptrice aux récepteurs du TRAIL qui pourrait mener à une telle activité est encore contreversée. Certaines études ont suggérées une voie dépendente de FADD et d'autres le contraire et il en est de même pour l'association d'autres molécules tel TRADD, FADD, TRAF2 et RIP(revue dans[100, 1041). 1.3 Le CD40 et la mort cellulaire Au CD40 on a souvent associé des rôles plutôt positifs dans la prolifération et la différenciation comme il a été mentionné plus haut. Mais depuis quelques années, plusieurs études ont m i s en évidence un rôle pour le CD40 dans la mort cellulaire bien que ce récepteur ne possède pas de DD dans sa partie cytoplasmique, comme c'est le cas pour TNFR-1, Fas et TRAIL. Les première études ont démontré l'inhibition de la prolifération cellulaire de lymphomes B in vivo et Nt vitro de même que l'induction de l'arrêt du cycle cellulaire suivant l'engagement du CD40 à la surface de lymphomes B [los, 1061. Chez les myélomes on observe aussi une inhibition de la prolifération de même que l'induction de l'apoptose[l07, 1081. Hess et al.[109] ont pour leur part démontré la sensibilité de cellules transformées d'origine mésenchymales et épithéliales. On rapporte aussi l'induction de Fas et du TNFRl suite a une stimulation via le CD40 de même qu'une sensibilisation a la mort via ces récepteurs[liO-1121. Plus récemment une autre équipe est venu confirmé l'efficacité de l'engagement du CD40 à la surface de lymphomes B in vivo dans l'éradication de ces cellules[113]. Léveillé et al41 141 rapportent la sensibilité de lignées B EBV positives à la mort via le CD40 qui semble être une mort caspase indépendente, de même que TNFR et Fas indépendente, n'impliquant pas le clivage de la PARP, ni la synthèse protéique mais semble dépendre de cystéine et de sérines protéase. Finalement une étude récente suggère l'implication des céramides dans la mort induite via le CD40[115]. En effet cette étude suggère que l'engagement du CD40 à la surface de iymphocytes B transformées à I'EBV induit la mort cellulaire via la stimulation de sphingomyélinase neutre, I'hydrolyse de sphingomyeline et la production concornittante de céramides. 1.4 Hv~othèseet obiectifs de travail Le CD40 est une molécule rnultifonctionnelle dont l'engagement provoque différentes réponses biologiques; comme nous venons de le voir la réponse induite peut varier en fonction de divers facteurs tel le type cellulaire, l'état d'activation des cellules, la nature du ligand (ligand naturel ou anticorps), la présence de facteurs exogènes (ex.: cytokines) ou endogènes (ex.: le LMP-l), etc.. Bien que des corrélations ont pu être établies entre ces différentes réponses et l'activation de certaines molécules de signalisation, il reste que la signalisation via le CD40 n'est pas encore bien caractérisée. Ainsi mon projet portait sur un rôle biologique précis du CD40, soit l'induction de la mort cellulaire et la caractérisation des voies de signalisation impliquées dans cette mort. À l'origine de ce travail sont les observations suivantes: -premièrement, plusieurs études récentes ont suggéré un rôle pour le CD40 dans la mort cellulaire; de même, des études effectuées dans notre laboratoire ont d'ailleurs démontré la sensibilité de plusieurs lignées cellulaires à cette mort. Puisque cette mort n'a pu être observée que sur des lignées cellulaires EBV positives ou EBV transformées, une hypothèse avait été émise comme quoi l'état d'activation et /ou la présence de protéines encodées par I'EBV pouvaient influencé la susceptibilité à la mort via le CD40. Ainsi le premier objectif de mon travail était de vérifier cette hypothèse, c'est-à-dire déterminer s'il était possible d'induire la mort via le CD40 dans des cellules ne portant pas I'EBV, et le cas échéant de caractériser cette mort. -deuxièment, l'implication de diffdrentes molécules de signalisation, telles les kinases, a été rapportée dans plusieurs systèmes de mort cellulaire et puisqu'il a été démontré que l'engagement du CD40 peut provoquer l'activation de certaines de ces molécules il est probable que la réponse de mort cellulaire dépende aussi de l'activation de ces molécules. Ainsi mon deuxième objectif de travail était de déterminer l'implication de différentes molécules de signalisation dans le processus de mort cellulaire induite via le CD40. Chapitre 2 Matériel e t Méthodes Li'ées cellulaires Les lignées cellulaires EBV négative Ramos et EBV positive Raji, toutes deux étant des lymphomes de Burkitt (ATCC), ont été maintenues en culture dans du RPMI 1640 (Celltech) additionné de FBS IO%, L-glutamine, pénicilline, streptomycine et du 2-betarnercaptoéthanol. Les lignées issues de fibroblaste de souris LTK(-) et LTK(-) transfectée avec le ligand du CD40(LTK(-)-gp39) ont été maintenues en culture dans du MEM additionné de FBS 1O%, L-glutamine, pénicilline, streptomycine et du 2-beta- rnercaptoéthanol et proviennent de J.-P. Valet. Anticorps et Réactifs L'anticorps monoclonal d - C D 4 0 (G28.5), l'anti-gp39 et l'anti-classe 1 (W632) proviennent de chez ATCC. La staurosporine, la génistéine, le LY et la wortmannine proviennent de chez Sigma. Détection de la mort cellulaire La mort cellulaire a été déterminée selon la méthode que nous avons précédemment décrite [114]. Brièvement, les cellules (5 x 105 C M ) stimulées dans une plaque de 96 puits ont été resuspendues, recueillies, et tramferrées dans des tubes Titerteck(I3ioRad) et colorées avec du bromure dYéthidium(EtE?r,4pg/ml)(Sigma) sur glace de 5 à 30 minutes. La mort cellulaire a été quantifiée par cytornétrie en flux, les cellules mortes démontrant une réduction dans leur taille qui se réflète par une diminution du FSC(foward light scattering properties) ainsi qu'une perte de l'intégrité membranaire qui se réflète par l'incorporation dYEtBr. Pour détecter la translocation des phosphatidylsérine (PS) à la face extérieure de la membrane cellulaire, les cellules ont été stimulées 18 heures, lavées, et colorées avec de l'annexin V et ensuite colorées avec de l'iodure de propidium selon la méthode décrite par la compagnie(Apoptosis Detection kit, de R&D systern). La mort cellutaire put ensuite être quantifiée par cytométne en flux. Mesure de la prolifération Les cellules (5 x 105 C / d ) ont été stimulées dans des plaques de 96 puits avec les anticorps et les réactifs indiqués dans la légende de la figure, pour une période de 30 heures. La 3 ~ - thymidine a ensuite été ajoutée et Ia plaque fùt incubée pour une période supplémentaire de 18 heures après quoi la plaque a été récupérée et l'incorporation de 3~-th~midïne a été mesurée par un compteur coulter-beta. Co-culture Les cellules Ramos (5 x 105 C M ) traitées ou non-traitées au PMA 0.25ng/ml pour 24 heures, ont été recueillies, lavées, resuspendues et CO-cultivéesà différents ratios avec des cellules LTK(-) ou LTK(-)-gp39 qui avaient préalablement été déposées dans les puits d'une plaque de 96 puits 24 heures auparavant. Lors de l'utilisation d'anti-gp39, cet anticorps f i t ajouté aux cellules LTK une heure avant l'ajout des cellules Ramos. Après 24 heures de CO-culture, les cellules Ramos furent recueillies et la mort cellulaire quantifiée comme nous venons de le décrire. Mesure de l'activité PKC Après avoir stimulé les cellules comme il est mentionné dans la légende des figures concernées, les cellules ont été homogénisées dans lOmM Tris-HCL pH 7.4, 12.5mM EGTA, 0.51nM dithiothéitol, 17pg/ml PMSF, Spg/ml leupeptine, Spglml antipaine, 5 pghnlpepstatine et 0.1% triton lOOx et centrifugée a 10 OOOxg pendant 10 minutes à 4OC. Des aliquots de 30pg de protéines ont été mélangés avec 50mM HEPES pH 4 contenant 20nM MgCl*, 8mM CaCl2, 100pM MBP, 025mM ATP, 5pg phosphaidylsérinc, 5pg diacylglycéride. L'initiation 32 de la réaction a été faite par l'addition dYATP(gamma-P ) 5pCi pour 20 minutes à la température de la pièce et arrêtée en déposant l'échantillon sur du papier filtre Whatmann de 3x3 cm. Après avoir séchés, les fütres ont été lavés 2 fois avec du TCA 25% et rincés à l'éthanol 100%. La quantité de radioactivité incorporée a ensuite été déterminée. L'incubation en absence de substrat a servi de contrôle et la valeur de ce contrôle a été soustrait du compte des échantillons. L'activité a été déterminé en calculant la quantité(nh4) de P32 transféré par mg de protéine totale par minute. Chapitre 3 Résultats* Les résultats présentés dans cette section font l'objet d'un article en préparation. 3.1 Descri~tiondes résultats 3.1.1 L'activation des cellules Ramos induit leur sensibilitk à la mort via le CD40. Nous avons précédemment démontré que l'engagement du CD40 exprimé à la surface de différentes lignées cellulaires de lymphocytes B peut conduire à la mort d'un certain pourcentage de ces celIules[114]. L'état d7activation/transfonnationdes cellules semblait influencer grandement la sensibilité à cette mort puisque seules les lignées EBV positives ou transformées à 17EBVpouvaient être tuées par l'engagement du CD40. Afin d'étudier cette influence, nous avons utilisé la lignée cellulaire Ramos, qui est un modèle de lymphocytes B immatures et qui de plus, est EBV négative. Cette lignée cellulaire qui présente un bon niveau d'expression du CD40, est insensible à la mort induite via le CD40; nous avons donc activé ces cellules avec diverses concentrations de PMA, allant de O.lng/ml à 100ng/ml, en présence d'anticorps monoclonaux anti-CD40, le G28.5, ou d'un isotype contrôle, le W632, qui est un anticorps dirigé contre les molécules du CMH de classe 1, pour une période de 48 heures. Des essais de prolifération démontrent que les cellules Ramos traitées avec une concentration grandissante de PMA seul ou de PMAtisotype contrôle provoquent une diminution progressive de l'incorporation de la thymidine-~3en fonction de la concentration de PMA utilisée. Alors que l'anti-CD40 seul n'induit pas une diminution significative de la prolifération, en présence de PMA on observe une diminution marquée lorsque comparé aux contrôles (Figure 1, A). Dans cette même expérience, nous avons voulu déterminer si cette inhibition de prolifération correspondait a une forme de mort cellulaire. Ainsi les cellules ayant subit les traitements cihaut mentionnés ont été mises en prksence de bromure d'éthidium afin de voir et de quantifier par cytométrie en flux, la mort cellulaire. En accord avec les résultats de prolifération, les cellules traitées au PMA seul ou PMA+isotype contrôle présente un pourcentage de mort cellulaire qui augmcnte avec la concentration de PMA utilisé; en présence d7anti-CD40,cette augmentation est encore plus grande atteignant -50% de mort cellulaire à une concentration de 0.25ng/ml de PMA (Figure 1, B). Nous avons donc utilisé cette concentration optimale de PMA, 0.25ng/ml, pour démontrer que cette réponse est aussi dépendante de la concentration d'anticorps anti-CD40 utilisé, la réponse maximale de mort cellulaire étant atteinte à une concentration de 1pg/ml de G28.5 Figure 2). Dans ces expériences que nous venons de présenter, les cellules étaient toujours costimulées~~+anticorps), ainsi nous avons voulu déterminer le temp d'activation au PMA nécessaire pour sensibiliser les Ramos à la mort via le CD40 et nécessaire pour induire un pourcentage élevé de mort celiulaire. À cette fin, les cellules Ramos ont été traitées au PMA O.SSng/ml pour différente période de temps, lavées et ensuite incubées en présence de G28.5 ou de W632 pour 24 et 48 heures. Ainsi, on constate que la sensibilité à la mort via le CD40 est proportionnelle au temps de pré-incubation au PMA et que l'incubation de 48 heures en présence de l'anti-CD40 permet un plus fort pourcentage de mort cellulaire (Figure 3). Si on compare avec les résultats précedemment obtenus, on constaste qu'une activation au PMA de 24 heures, suivi d'une stimulation de 48 heures avec l'anti-CD40 est nécessaire pour obtenir un pourcentage de mort comparable. Ces conditions expérimentales seront donc subséquemment utilisées dans certaines expériences puisqu'elles nous permettront de distinguer Les éléments propres à l'activation de ceux du processus de mort cellulaire induite via le CD40. Par la suite, nous avons voulu confirmer nos observations concernant le phénomène de mort cellulaire, par un essai à 17annexinV/PI,cette méthode ayant fait ces preuves quant à la détection précoce des cellules apoptotiquesC116, 1171. Comme nous pouvons le voir à la figure 4, les cellules Ramos costirnulées au PMA 0.25ng/ml et au G28.5 pour une période de 18 heures, présentent une augmentation significative de I'externalisation des phosphatidylsérines (25.9%) comparativement aux cellules non-stimulées, ou stimulées au PMA seul ou G28.5 seul, et ce sans une augmentation similaire en incorporation d'iodure de propidium(PI), démontrant que ce phénomène apoptotique vient avant la perte de l'intégrité membranaire que nous avons précedemrnent mesuré par l'incorporation de EBr. Un certain nombre d'études ayant demontrées que les conséquences de l'engagement du CD40 peut, entre autre, dépendre du type de ligand utilisé[ll8, 1191, nous avons voulu comparer l'effet de l'engagement du CD40 à la surface des celIules Ramos par son ligand naturel, le CD40L ou gp39, à celui de l'anti-CD40 que nous avons utilisé jusqu'à maintenant. Afin de répondre à cette question, des cellules Ramos traitées et non-traitées au PMA 0.25ng/ml pendant 24 heures, ont été cocultivées avec des cellules LTK(-) et LTK(-) transfectées avec le gp39(LTK(-)-gp39), et ce à différents ratios, pour une période de 24 heures. Les résultats obtenus (Figure 5) démontrent que les Ramos activées et cocultivées avec les LTK(-)-gp39, mais pas avec les LTK(-), présentent un pourcentage de mort significatif et comparable à celui obtenu avec le G28.5 pour la même période d'incubation (voir Figure 3). 11 est aussi intéressant de noter, qu'à la différence du G28.5, les cellules Ramos non-activées et mises en coculture avec les LTK(-)-gp39 présentent aussi un certain pourcentage de mort, mais cette réponse est augmentée de manière significative lorsque les cellules sont pré-traitées au PMA. Ncus démontrons aussi que cette réponse est dépendante du ratio Rarnos:LTK(-)-gp39, 1:l étant le plus efficace; nous démontrons aussi que cette réponse est bien spécifique puisqu'elle est entièrement bloquée par des anticorps anti-gp39. 3.1.2 La mort cellulaire induite via le CD40 dans les Ramos activées est dépendante des PKC. L'engagement du CD40 à la surface de divers types cellulaires induit une variété de réponse implicant l'activation de nombreuses molécules de signalisation, comme certaine PTK, PKC et PI3-kinase(revue d m [28]). Puisque plusieurs études ont aussi m i s en évidence le rôle des kinases dans la régulation de l'issu, telle la mort ou la survie cellulaire, d'un grand éventai1de stimuli[lSO], nous avons voulu déterminer leur implication possible dans le processus de mort des Ramos activées induit par le CD40. Ainsi, des cellules Ramos pré-traitées au PMA O.SSng/rnl pour 24 heures, ont ensuite été incubées pendant 1 heure avec différents inhibiteurs, puis stimulées pour 48 heures avec le (328.5 ou un isotype contrôle (W632). La staurosporine, un inhibiteur de PKC, est le seul à avoir pu inhiber la mort cellulaire, et ce a plus de -50% à 10 n M (Figure 6, A). La genisteine, un inhibiteur de PTK,n'a eu aucun effet sur la mort, mais à forte concentration, cet inhibiteur semble induire la mort à lui seul des cellules Ramos activées (Figure 6, B). Finalement, les deux inhibiteurs de PI3-kinase (LY et Wortmannin) n'ont pu eux aussi affecter cette mort induite via le CD40 (Figure 6, C et D). Les résultats obtenus jusqu'à maintenant démontrent que l'activation des cellules Ramos fait passer le rôle du CD40 de la survie (lorsque stimulé via le BCR[121, 1221) à la mort cellulaire. Il a aussi été rapporté que l'engagement du CD40 à la surface des cellules Ramos ne mène pas à l'activation des PKC[69]. Pourtant les résultats que nous avons obtenus suggèrent fortement l'implication de cette famille de kinase dans la mort via le CD40 des Ramos activées. M n de clarifier cette question, des cellules Ramos traitées au PMA O.SSng/ml pour 24 heures, ont ensuite été stimulées avec le G28.5 ou le W632 ou le PMA 200ng/ml, puis l'activité PKC a ensuite été déterminée pour chacun de ces échantillons (Figure 7). En accord avec ce qui avait précedemment été rapporté, l'engagement du CD40 chez les cellules Ramos non-activées ne conduit pas à l'activation des PKC, mais une fois les cellules activées, cette engagement permet une activité PKC signincative qui est comparable à celle induite par le PMA 200ng/ml. Nous avons précedemment rapporté certaines caractéristiques de la mort cellulaire induite via le CD40 dans les cellules RajiC1141. Le présent travail nous a permis d'établir certaine similarité entre cette mort et celle que nous observons dans les Ramos activées. Tout d'abord, cette mort est indépendante du système d'adhésion LFA-I/ICAM-1 puisque les cellules Ramos sont des cellules LFA-1 négatives; des anticorps neutralisant anti-FasL, anti-TRAIL et ad-TNFR n'ont pu inhiber cette mort (CCdata not shown") et cette mort est aussi caspase indépendante puisque deux inhibiteurs de caspase à large spectre (Z-Asp-CH2-DCB et ZVAD-fi&) n'ont eut aucun effet sur cette mort ("data no2 shown "). A la lumière de ces similaritées, nous avons ensuite voulu comparer l'effet des différents inhibiteurs de kinase sur Ia mort via le CD40 dans les cellules Raji. Nous avons donc stimuié les cellules Raji via le CD40 suivant une préincubation avec les même inhibiteurs que nous avions utilisés pour les Ramos activées (voir Figure 6). Comme ce fut le cas pour les Ramos activées, la staurosporine est le seul inhibiteur qui a pu affecter cette mort dans les cellules Raji, et ce, à un pourcentage d'inhibition comparable, soit -50% (Figure 8, A). Nous avons Mernent voulu confirmer ces résultats par une mesure de la capacité du CD40 exprimé a la surface des cellules Raji d'induire une activité PKC et les résultats obtenus démontrent qu'il y a effectivement une induction de cette activité suivant l'engagement du CD40 par l'antiCD40, G28.5 (Figure 8, B). 3.2 Présentation des fipures Figure 1: L'activation des cellules Rarnos confère un sensibilité à la mort induite via le CD4O. Les cellules Rarnos (5 x 105 C/ml) ont été incubées avec I'anti-CD40 G28.5 (2pghl) ou un isotype contrôle W632 en présence de différente concentration de PMA. (A) Après 30 heures d'incubation, la t l ~ ~ r n i d i n ae -étd ~ ~ajoutée et son incorporation mesurde après avoir poursuivi l'incubation 18 heures de plus. (E3) Après 48 heures d'incubation, la mort cellulaire a été quantifiée par l'incorporation du bromure d'dthidium (4pg/ml). Les résultats d'une expérience représentative d'au moins trois sont présentés sous forme de la moyenne obtenu par des mesures en triplica. Figure 2: La mort celIulaire induite via le CD40 chez les Ramos activdes est dépendante de la concentration d'anti-CD40 . Les cellules Rarnos (5 x 105 C/rnl) ont été incubées avec différentes concentrations d'anticorps antiCD40 G28.5 en présence de PMA 0.25ng/ml pour une période de 48 heures puis la mort cellulaire a été quantifide par l'incorporation du bromure d'ethidium. Les résultats pr6sentés sont la moyenne de trois expériences faites en duplica. pre-incubation time with PMA0.25ng/ml (hr) Figure 3: Cinétique de l'activation au PMA nécessaire pour induire la sensibilité à la mort cellulaire induite via le CD40 dans les Ramos. Les cellules Ramos (5 x 105 C/ml) ont été pré-activées au PMA 0.25nghl pour les différents temps indiqués, lavées et ensuite stimulées avec l'anti-CD40 G28.5 (2pg/ml) ou un isotype contrôle W632 pour 24 et 48 heures. La mort cellulaire a ensuite ét6 quantifiée par la mesure de l'incorporation du bromure d'éthidium. Les résultats présentés sont la moyenne de trois expériences faites en duplicata. O .t-% MED 1.ab 1.?,9~ PMA Figure 4: L'engagement du CD40 ih la surface des Rarnos activées induit leur apoptose. Les cellules Rarnos (5 x 105 C h i ) ont été stimuiées soit en présence d'anti-CD40 G28.5 (2pg/ml) ou du PMA 0.25ng/ml ou la combinaison des deux pendant 18 heures et la réponse apoptotique a été quantifiée comme décrit dans le matériel et méthodes. Les résultats d'une expérience représentative sont présentés. non-treated cells treated cells PMA 0.25ng/ml24hrs Figure 5: Le ligand naturel du CD40 peut aussi induire la mort des Ramos activées. Les cellules Ramos traité au PMA 0.25ng/ml pendant 24 heures ou non-traitées ont été cocultivées à différents ratios avec des cellules LTK(-), LKT(-)-gp39 ou LTK(-)-gp39 en présence d'anticorps bloquant anti-gp39, pour une période de 24 heures et ce à divers ratios Ramos:LTK. Les Ramos ont ensuite été recueillies et la mort cellulaire a été quantifiée par la mesure de l'incorporation du bromure dY6thidium.Les résultats présentés sont la moyenne de trois expérience faite en duplicata. Figure 6: La mort cellulaire induite via le CD40 daniles Rmmos activés implique les PKC. Les cellules Ramos (5 x 105 C h l ) pré-activees au PMA 0.2Snghl pendant 24 heures, ont ensuite été incubées avec les concentrations indiquées de staurosporine, un inhibiteur de PKC (A), de génistéine, un inhibiteur de PTK (B), de LY(C) et de Wortrnannin (D) deux inhibiteurs de P13-kinase. Après 1 heure d'incubation en présence de ces inhibiteurs, l'anti-CD40 G28.5 (2pg/ml) ou t'isotype contrôle W632 a été ajouté et l'incubation poursuivi pour 48 heures. La mort cellulaire a été quantifiée par la mesure de l'incorporation du bromure d'éthidium. Les résultats d'une expérience représentative d'au moins trois sont présentés sous fonne de la moyenne obtenu par des mesures en triplicata. I non treated ceüs CItreated cells MED W632 G28.5 PMA igure 7: L'activation des Ramos confère la capacité au CD40 d'induire une activité PKC. Les cellules Ramos (5 x 105 Chi) traitées au PMA 0.25nghl ou non-traitées pendant 24 heures ont été stimulées avec l'anti-CD40 G28.5 (2pg/mi) ou l'isotype contrôle W632 ou le PMA 200ng/ml pour 10 minutes et l'activité PKC a été mesurée comme décrit dans le matériel et méthodes. Les résultats présentés sont ceux d'une expérience reprdsentative de deux expériences. MED W632 G28.5 PMA staurosporine (nlM) Figure 8: La mort induite via le CD40 dans les Raji implique les PKC et corrèle avec la capacité d'induire une activit6 PKC. (A) Les cellules Raji (5 x 105 C/ml) ont etd incubdes 1 heure en présence des concentrations indiqudes de staurosporine avant l'ajout d'anti-CD40 G28.5 (2pg/ml) ou d e I'isotype contrôle W632. Après 10 heures d'incubation la mort cellulaire a été quantifiée par la mesure de l'incorporation du bromure d'éthidium. (B) Les cellules Raji (5 x 105 C/ml)ont été stimulées avec l'anti-CD40 G28.5 (2pgfml) ou l'isotype contrôle W632 ou le PMA 200ng/ml pour 10 minutes et l'activité PKC a été mesurée comme ddcrït dans le matériel et mdthodes. Les résultats présentés sont ceux d'une expérience représentative de trois expbriences. Chapitre 4 Discussion générale et conclusions Les voies de signalisation et de régulation des lymphocytes B varient en fonction du stade de différenciationde ces cellules. Ce phénomène peut en partie être expliqué par le fait que lors du développement des lymphocytes B, certaines molécules sont exprimées a divers stades de ce processus, de manière transitoire ou persistante. Ainsi, certaines molécules de signalisation ou certains inhibiteurs ou récepteurs peuvent être présents ou absents à divers stades de différenciation et d'activation ou suite à un processus d'immortalisation. Il est alors possible que l'engagement d'un même récepteur, qui serait présent à la surface des lymphocytes B à divers stades de son développement n'induise pas le même signal et que les conséquences fonctionnelles de cet engagement soient aussi dBérentes[l23]. Un de ces récepteurs faisait l'objet du présent travail, soit le CD40. Comme nous l'avons vu, cette molécule est exprimée tôt lors du développement des lymphocytes B et persiste jusqu'au stade de plasmocyte[3]. Tout au long de ce parcours de maturation, l'engagement du CD40 provoquera diverses réponses que nous avons détaillées précedemment et qui sont surtout considérées comme positives telles la prolifération , la différenciation et la sunrie[3]. Mais comme d'autres membres de la famille de récepteur TNF, en plus de jouer un rôle dans la prolifëration et la différenciation, nous avons vu que le CD40 joue aussi un rôle dans la mort cellulaire[l05-1151. Les observations qui ont été rapportées, de même que les précédents travaux effectués dans notre laboratoire démontrent une certaine tendance quand à ia sensibilité à la mort induite via le CD40. En effet, jusqu'à maintenant cette sensibilité n'avait été rapporté que chez des lignées de lymphocytes B transformées à I'EBV, tandis que chez les lignées EBV négatives le CD40 jouait plutôt un rôle dans la survie de ces cellules. Ces études suggéraient un rôle possible pour l'état de transformation etfou d'activation des cellules dans la susceptibilité à la mort via le CD40 et corrélaient avec certaines études rapportant l'altération possible, par le LMP-1, des voies de signalisation induite via Ie CD40[65]. Ainsi, le présent travail a été entrepris a h d'investiguer ces possibilités. Les résultats présentés dans ce travail démontrent que l'état d'activation semble être un facteur beaucoup plus déterminant que la présence de L'EBV dans la sensibilité à la mort via le CD40. En effet pour cette étude nous avons utilisé la lignée du lymphome de Burkitt Ramos qui est un modèle de lymphocyte B immature et qui est aussi EBV négative. Il est bien documenté dans la littérature que L'engagement du CD40 sur ce type de cellules n'induit pas la mort mais plutôt les "sauventyyde la mort induite via le BCRC12 1, 1221. Nous avons démontré que suite à une activation au PM& l'engagement du CD40 par des anticorps induit un fort pourcentage de mort cellulaire. Le fait que la conséquence fonctionnelle de cette engagement passe d'un signal de survie à un signal de mort implique que la voie de signalisation empruntée n'est pas la même. Comme nous l'avons démontré, une fois les cellules Rarnos activées, l'engagement du CD40 à la surface de ces cellules conduit à une activation des PKC. Mais le mécanisme par lequel cette activation arrive à modifier la voie de signalisation du CD40, conduisant à la mort d'un fort pourcentage de ces cellules, n'a pu être élucidée. Parmis les possibilités existantes, était celle de l'implication de d'autres membres de la famille TNFR. En effet, le CD40 ne possédant pas de "death domain" dans sa partie cytoplasmique, il était possible que cette activation menait à une augmentation d'autres récepteurs de cette famille qui porte ce "death domain", et de ce fait à une sensibilisation à la mort via ceux-ci. De tels cas on déjà été rapportés[l 11, 1123, mais dans notre système, cette hypothèse s' est avérée négative. Une autre possibilité concerne les formes de CD40 qui sont exprimées à la surface de la cellule. En effet, suite à l'activation au PMA nous avons observé une augmentation de l'expression du CD40 ("data not shown "), mais la forme sous laquelle ces molécules sont exprimées n'est pas connu. Certaine études ont démontré que la forme du CD40 jouait un rôle crucial dans le recrutement et l'affinité de certaines molécules, comme les T&W, pour la queue cytoplasmique du CD40 (revue dans[28]). Ainsi il est possible que de nouvelles formes de CD40 permettent un recrutement différent de molécules et que ces molécules soient liées à l'induction de la mort. Le fait que sur la lignée cellulaire Raji qui est sensible à la mort via le CD40,cette molécule est exprimée sous forme de dimères11241 et que le ligand naturel du CD40, qui multimérise le CD40, induise à lui seul un certain pourcentage de mort cellulaire supporte cette hypothèse (aussi rapporté dans [59, 1251). Comme nous l'avons déjà mentionné, les signaux induits via le CD40 sont en partie médiés grâce à l'association de plusieurs protéines à la queue cytoplasmique du récepteur. Parmi ces molécules on compte différents membres de la famille des TRAF (TRAF-1,-2,-3,-5,-6) et d'autres comme Ku, Jak3 et tout récemment la protéine TTRAP (TRAF and TNF receptorassociated protein)[l26] est venue s'ajouter à cette liste. Le rôle de chacune de ces molécules dans la signalisation induite via le CD40 n'a pas encore été élucidé, ainsi il est difficile de supposer avec assurance, laquelle pourrait être impliquée dans la mort cellulaire. Mais quelques possibilités semblent plus probable que d' autres. Plusieurs études rapportent un rôle pour les TRAF dans l'activation de NF-kappa& JNKLWE'K, ERK et I'apoptose. Bien que TRAF3 soit associé à la voie apoptotique induite via LTbetaR[l27], il est peu probable qu'il en soit de même pour le CD40. En effet, utilisant un dominant négatif de TRAF3, Grammer et aI.[59] ont démontré que cette molécule n'était pas impliquée dans la mort induite via le CD40 chez les lymphocytes B. Plusieurs évidences suggèrent que le candidat le plus probable parmi les TRAF serait TRAF6. En effet, une étude récentel1281 rapporte que l'habileté du CD40 à induire la mort cellulaire dépend d'un domaine de la queue cytoplasmique du récepteur situé à proximité de la membrane (résidue 2 16-239)' mais n'impliquant pas la séquence PXQXT. Or, il a été établi que les TRAF- 1 ,-2 et -3 se lient au CD40 via cette séquence PXQXT et que le TRAF6 se lie plus près de la membrane[53]. De plus, le TRAF-6 se lie aussi à la molécule RIP-2 qui possède un domaine CARD (C-terminal caspase activation and recruitment domain)[129]. Parmi les molécules associées se liant à la partie cytoplasmique du CD40 se situant à proximité de la membrane, il y a Jak3 et la nouvelle molécule TTRAP pour lesquelles un rôle dans la mort ce~lulairereste à déterminer. Un autre candidat pourrait être TRAF-2, auquel on associe l'activation de JNK; TRAF-2 s'associe aussi à TRADD qui est entre autre impliqué dans la voie de mort via le TNF-Rl en permettant le recrutement de FADD [28]. Ces possibilités que nous venons d'énumérer semblent surtout liées la voie de mort à l'activation des caspases, mais dans notre système et dans les travaux que nous avons précedemment publiés, I'utilisation d'inhibiteurs de caspases n'a eu aucun effet sur cette mort. Plusieurs études ont rapporté l'induction de la mort de manière caspase indépendante (revue dans[130-1321). Entre autre, la production de céramide, menant à l'activation de molécules de signalisation tel JNK ou certaines phosphatases, à été observée dans des processus de mort caspase indépendants[133436L Il est donc possible que la mort induite via le CD40 implique la génération de céramides, comme il a été rapporté par Armour et al. et plus récemment par Metkar et al.[115, 1373. Plusieurs travaux ont démontré un rôle pou. les PKC dans la mort cellulaire(revue dans[lSO]). Ce que nous avons observé dans le présent travail, c'est-à-dire que dans deux lignées cellulaires différentes la sensibilité à la mort via le CD40 corrèle avec la capacité du CD40 à induire une activité PKC, supporte cette implication. Mais il reste à déterminer comment l'engagement du CD40 conduit à l'activation des PKC dans les Ramos activées a la différence des Raji qui possèdent cette habilité de manière intrinsèque. Comme nous l'avons suggéré plus haut, il est possible que l'activation par le PMA affecte le répertoire de molécules liées au CD40 et ainsi modifie la voie de signalisation empruntée. A cet effet, une étude récente à établi un lien entre l'activation des PKC via TNF-R1 et le recrutement de TRAF-6[138]. Par, entre autre, l'utilisation de divers inhibiteurs, le rôle des PTK dans la signalisation propre au CD40 a été décrit[28, 105, 139-1411; mais d'après les résultats présentés dans ce travail, leurs rôles dans la mort cellulaire n'est pas clair. Les résultats obtenus avec la génistéine montre qu'une activité PTK basale semble nécessaire à la survie des Ramos activées puisque l'inhibiteur seul induit un certain pourcentage de mort cellulaire, mais lorsque 1'4-CD40 est ajouté la mort cellulaire induite via ce récepteur n'est pas affectée. Ainsi il est possible qu'une activité PTK ne soit pas nécessaire pour la mort cellulaire induite via le CD40 mais que plutôt l'engagement du CD40 à la surface des Ramos activées mène, par un mécanisme PKC dépendant, à l'inhibition d'une activité PTK. Ainsi, dans ce travail nous avons démontré un rôle pour l'activation dans la susceptibilité a la mort via le CD40 et que puisque la lignée cellulaire Ramos est EBV négative nous pouvons dire que cette mort est indépendante de la présence de protéines encodées par lYEBV,telle Le LMP-1. Mais une autre façon de voir les choses serait de dire que le L W - 1 joue le même rôle que l'activation, c'est-à-dire qu'il modifie le répertoire de molécules disponibles qui peuvent se lier au CD40. En effet ,les cellules Raji qui sont sensibles a la mort via le CD40 sont EBV positives et la molécule LMP-1 est exprimée. Cette molécule possède une afnnité pour certain TRAF tel le TRAF-1, -2 ,-3[142]. Ainsi il est possible que dans les cellules Raji, le fait que le répertoire de TRAF disponible pour le CD40 soit modifié permet la liaison d'autres molécules qui ne pourraient autrement se lier. Dans les cellules Ramos, l'activation pourraient avoir un effet similaire comme par exemple en causant la phosphorylation de certains TRAF inhibant ainsi la capacité à lier le CD40. À cette égard il a été rapporté que la phosphorylation de TRAF-2 inhibe sa liaison à la queue cytoplasmique du CD40 [143]. L'activation de PKC par le traitement au PMA pourrait aussi mener à l'inactivation de certaines molécules de signalisation qui ainsi ouvriraient une nouvelle voie pour le CD40, dans le cas présent cette voie menant à la mort. À cet effet Liu et al.[144] ont démontré que l'activation des PKC par le PMA avait pour conséquence l'inhibition de l'induction via le TCRKd3 du phénomène de phosphorylation des tyrosines de la protéine Cbl (C-cbl protooncogene) et de ses fonctions. Un tel phénomène pourrait aussi être présent dans notre système. Finallement, comme nous l'avons mentionné au tout début de cette discussion il est possible que l'engagement d'un même récepteur, qui serait présent à la surface des lymphocytes B à diverses étapes de son développement n'induise pas le même signal puisque la présence, l'absence ou la disponibilité de certaine molécules, de signalisation par exemple, varie à chacune de ces étapes ou suivant un processus d'immortalisation, et ainsi les conséquences fonctionnelles de cet engagement sont aussi différentes. Le travail que nous venons de présenter en est un bon exemple. Chapitre 5 Perspectives Le présent système dans lequel les cellules Ramos non-activees sont insensibles à la mort via le CD40 et les cellules activées sont susceptibles à cette mort en fait un excellent système pour élucider la voie de mort induite par l'engagement du CD40. En effet, il pourrait permettre, par comparaison, d'établir certaines corrélations e&e des modifications apportées par l'activation et la sensibilité à la mort induite via le CD40. Il serait intéressant de déterminer dans un premier temps comment l'activation induit la sensibilité à la mort via le CD40. Afin de répondre à cette question il faudrait voir si d'autres activateurs pourraient avoir un effet similaire au PMA; déterminer quelles molécules peuvent s'associer à la queue cytoplasmique du CD40 et si le répertoire de molécules varie dans les cellules activées et non-activées; comparer aussi l'engagement du CD40 par le CD40L et les anticorps anti-CD40 au niveau des molécules recrutées et voir s'il est possible d'obtenir une réponse sunilaire à celle induite par le CD40L par l'utilisation de CD40L soluble; déterminer l'effet de divers anticorps dirigés contre des épitopes différents du CD40; il faudrait aussi voir si les formes sous lesquelles le CD40 est exprimé avant et après l'activation et aussi suivant son engagement par le CD40L; déterminer la sensibilité d'autre types cellulaires ou de cellules normales à divers stade d'activation. Le deuxième aspect qu'il serait important d'aborder est la caractérisation de cette mort, c'està-dire d'éclaircir la voie de signalisation qui conduit à cette mort. Nous avons démontré que l'activation qui induit une sensibilité à la mort induite via le CD40 corrèle aussi avec une modification dans la voie de signalisation, soit l'induction d'une activité PKC. À cette effet, il serait intéressant de connaître les isoformes impliqués de même que les substrats de cette famille de kinase qui ont un rôle à jouer dans la voie de mort. L'implication de différentes molécules de signalisation tel SAPK/JNK, des céramides ou des phosphatases seraient aussi très intéressantes à déterminer. Ainsi, l'étude des méchanismes et la détermination des molécules qui conferent la sensibilité à la mort via le CD40 et celles qui sont impliquées dans la voie de mort en tant que telle, permettront éventuellement la création d'outils thérapeutiques servant entre autres à l'élimination des cellules tumorales. Bibliographie 1. Paulie S., Ehlin-Henriksson B., Mellstedt H., Koho H., Ben-Aissa H. & Perlmann P. 1985. A p5O surface antigen restricted to human urinary bladder carcinomas and B lpphocytes. Cancer Immunol Immunother, 20,23-8. 2. Clark E.A. & Ledbetter J A . 1986. Activation of human B cells mediated through two distinct cell surface differentiation antigens. Bp35 and BpSO. Proc Natl Acad Sci U S A, 83, 4494-8. 3. Banchereau J, Bazan F., Blanchard D., Briere F., Galizzi J.P., van Kooten C.,Liu YJ.,Rousset F. & Saeland S. 1994. The CD40 antigen and its ligand. Annu Rev Immunol, 12, 881-922. 4. Ramesh N., Ramesh K, Gusella J.F. & Geha R 1993. Chromosomal localization of the gene for human 23-cell antigen CD40. Somat Cell Mol Genet, 19, 295-8. 5. Grimaldi J.C., Torres R., Kozak C A . , Chang R., Clark E.A., Howard M. & Cockayne D.A. 1992. Genomic structure and chromosomal mapping of the murine CD40 gene. J Irnmunol, 149, 3921-6. 6. Starnenkovic I., Clark E.A. & Seed B. 1989. A B-lymphocyte activation molecuIe related to the nerve growth factor receptor ami induced by cytokines in carcinomas. Embo J. 8, 1403-1O. 7. Saeland S., Duvert K, Caux C.,Pandrau D., Favre C., Valle A., Durand 1,Charbord P., de Vries J: & Banchereau J. 1992. Distribution of surj8ce-membrane molecules on bone marrow and cord blood CD34+ hemntopoietic cells- Exp Hematol, 20, 24-33. Uckun F. M-, Gajl-Peczalska K., Myers D.E., Jaszcz W., Haissig S. & Ledbetter J.A. 8. 1990. Temporal association of CD40 anîigen expression with discrete stages of human B-cell ontogeny and the eflcacy of anti-CD40 immunotoxins against clonogenic B-lineage acute lymphoblastic leukemia as well as B-lineage non-Hodgkin s' Zymphoma cells. Blood, 76, 244956. 9. Law C.L., Wornzann B. & LeBien T. W. 1990. Analysis of expression andfunction of CD40 on normal and leukemic human B cellprecursors. Leukernia, 4, 732-8. IO. van Kooten C., Gaillard C , Galizzi JP.,Hermann P., Fossiez F., Banchereau J. & Blanchard D. 1994. B cells regulate expression of CD40 ligand on activated T cells by lowering the mRNA level and through the release of soluble CD40. Eur J lmmunol, 24, 787- 92. II. Inaba K ,Witmer-Pack M , Inaba M-, Hathcock KS., Sukuta H., Azuma M., Yagita H-, Okumura K., Linsley P.S., Ikehara S. & et al. 1994. The tissue distribution of the B7-2 costimulator in mice: abundant expression on dendritic ceZls in situ and during maturation in vitro. J Exp Med, 180, 1849-50. 12- Alderson MX., Armitage R J , Tough T.W., Strockbine L., Fanslow W-C. & Spriggs M X 1993. CD40 expression by human monocytes: regulation by cytokines and activation of monocytes by the ligandfor CD40. J Exp Med, 178, 669-74. 13. Fanslow W.C., Clzrord K N , Seaman M., Alderson M X , Spriggs M X , Armitage R.J. & RamsdeZl F. 1994. Recombinant CD40 ligand exerts potent biologic efects on T c e k J Immunol, 152, 4262-9. 14. Spriggs M K ,RamsdeZZ FArmitage R.J., Tough T. W., Macduff B.M., Fanslow W.C., & Alderson M.R. 1993. CD40 ligand is a T cell growth factor. Eur J hrnunol, 23, 2326-31. 15. Ruggiero G., Cuceres E.M-, VoordouwA., Noteboom E., Graf D.,Kroczek R A . & Spits H. 1996. CD40 expressed on thyrnic epithelial cells provides costimuZationfor prolz~eration but no?for apoptosis of human thymocytes. J Immunol, 156, 3 737-46. 16. Hollenbaugh D., Mischel-Petty A?, Edwards C.P., Simon J. C., Denfeld R W., Kiener P.A. & Aruflo A. 1995. Expression of functional CD40 by vascular endothelial cells. J Exp Med, 182, 33-40. 1 7. Karmann K ,Nughes C.C., Schechner J.. Fanslow W.C. & Pober J.S. 1995. CD40 on human endothelial cells: inducibilify by cytokines and jùnctional regulation of adhesion moZecuZe expression. Proc Natl A cad Sci U S A, 92, 4342-6. 18. Peguet-Navarro J., Dalbiez-Gaufhier C., Moulon C.. Berthier O., Reano A., Gaucherand M., Banchereau J., Rousset F. & Schmitt D. 1997. CD40 ligation of human keratinocytes inhibits their proliferation aad induces their dzflerentiation J Immunol, 158, 144-52. 19. Denfeld R. W., Hollenbaugh D.. Fehrenbach A., Weiss LM.,von Leoprechting A., Mai B., Voith (I., Schopf E., Aruffo A. & Simon J E . 1996. CD40 is functionally expressed on human keratinocytes. Eur J hmunol. 26. 2329-34. Yellin ML, Winikof S., Fortune SM., Barn D., Crow M-K ,Ledeman S. & Chess L. 20. 1995. Ligation of CD40 on fibroblasts induces CD54 flCAiM-1) and CD1O6 (VCAnii-1) upregulation and IL-6production andproliferation J Leukoc Biol, 58, 209-16. 21. Clark LB.,Foy T.M. & Noelle R.J. 1996. CD40 and its ligand. Adv Immunol, 63, 43- 78, 22. Callard R.E., Smith SN..Herbert J., Morgan G., Padayachee M., Lederman S., Chess L,Kroczek RA., FansIow W.C. & Armitage RJ. 1994. CD40 ligand (CD40L) expression and B cell function in agarnmaglobulinemia with normal or elevated levels of IgM (HIM). Cornparison of X-linked autosomal recessive, and non-X-linked forms of the disease. and obligate carriers. J Immunol, 153, 3295-306. 23. Cosman D. 1994. A family of Zigand for the TN'" receptor superfami&. Stem CelZs, 12, 440-55. 24. Koshy M., Berger D. & Crow M K 1996. Increused expression of CD40 ligand on systemic lupus eryrhemafosuslymphocytes. J Clin Invest, 98, 826-3 7. 25. Desai-Mehta A., Lu L., Rarnsey-Goldman R. & Datta S.K 1996. Hyperexpression of CD40 ligand by B and T cells in human lupus and its role in pathogenic autoantibody production. J Clin Invest, 9 7, 2063- 73. 26. Pullen S.S., Labadia ME., Ingraham R H . , McWhirter S.M., Everdeen D.S., Alber T., Crute J.J. & Kehry M.R. 1999. High-aflnity interactions of tumor necrosis factor receptorassociatedfactors (TRA Fs) and CD40 require T U F trimerizution and CD40 multimerization. Biochemistry, 38, 10168-77. 27. Kehry M.R. & Castle B.E. 1994. ~egulationof CD40 ligand expression and use of recombinant CD40 ligand for studying B ce11 growth and dflerentiation. Semin Imrnunol, 6, 28 7-94. 28. Calderhead D M . , Kosaka K, Manning E.M. & Noelle R.J. 2000. CD40-CD154 interactions in B-cell signaling. Curr Top Microbiol Immunol, 245, 73-99. 29. van Kooten C. & Banchereau J. 1997. Immune regulaîion by cd40-cd404 interactions- Front Biosci, 2, d l -dl 1. 30. Hasbold J., Johnson-Leger C., Atkins C.J,Clark E.A. &'Klaus G.G. 1994. Properties of mouse CD40: ceIIuIar distriburion of CDQOund B ceII activation by monoclonal anti-mouse CD40 antibodies. Eur J Immunol, 24, 1835-42. 31. Knox KA. & Gordon J. 1993. Protein tyrosine phosphorylation is mandatory for CDIO-mediated rescue of germinal center B ceIZsfiom apoptosis. Eur J Immunol, 23, 257884- 32. Marshall LS..Shepherd DM., Ledbetter LA., Aruflo A. & Abelle R.J. 1994. Signaling events during helper T ceIl-dependent B cell activation. I. Analysis of the signal transduction pathays triggered by activated heIper T cell in resfing B ceZ1.s. J lmmunol, 152, 481 6-25. 33. Uckun F.M. Schieven G.L, Dibirdik L, Chandan-Langlie M., Tuel-Ahlgren L. & Ledbetter J.A. 1991. Stimulation of protein tyrosine phosphorylation, phosphoinositide turnover, and multiple previously unidentz3ed serine/threonine-specificprotein kinases by rhe Pan-B-ce21 receptor CD40/BpSO at discrete developmenfalstages of human B-cell ontogeny. J Biol Chem, 266, 1 7478-85. 34. Ren C.L.. Morio T.,Fu SM: & Geha R.S. 1994. Signal transduction via CD40 involves activation of lyn kinase and phosphatidylinositol-3-kinase, and phosphorylation of phospholipase C gamma 2. J Exp Med, 179, 673-80. 35. van Kooten C. & Banchereau J. 1997. Functions of CD40 on B cells, dendritic c e h and other cells. Curr Opin Immunol, 9, 330-7. 36. Faris M., Gaskin F., Parsons J.T. & Fu S.M. 1994. CD40 signaling pathway.. anti- CD40 monoclonal antibody induces rapid dephosphorylation andphosphoryIafion of tyrosinephosphorylated proteins including protein tyrosine kinase Lyn, Fyn, and Syk and the appearance of a 28-kD tyrosine phosphorylated protein. J Exp Med, 179, 1923-3 1. 3 7. Kansas G.S. & Tedder T.F. 1991. Transmernbrane signds generated through MHC class II. CD19, CD20, C . 3 9 , and CD40 antigens induce LFA-1-dependent and independent adhesion in hurnan B cells through a tyrosine kinase-dependent pathway. J Immunol, 147, 4094-102. 38. Faris M , Gaskin F., Geha R.S. & Fu SM. 1993. Tyrosine phosphorylation defines a unique transduction pathway in human B cells rnediated via CD40. Tram Assoc Am Physicians, 106, 187-95. 39. Sakata N , Kawusome R,Terada IV, Gerwins P.. Johnson G.L. & G e l f n d E. W. 1999. Dzxerential activation and replation of rnitogen-activated protein kinases through the antigen receptor und CD40 in human B cells. Eur Jhmunol, 29, 2999-3008. 40- Lapointe R,Lemieux R,Olivier M. & Darveau A. 1996. Tyrosine kinase and CAMP- dependent protein kinase activities in CD40-activated human B lymphocytes. Eur J Imrnunol, 26, 2376-82. 41. Worm M & Geha RS. 1995. CDQO-mediatedZymphotoxin alpha expression in human B cells is tyrosine kinase dependent. Eur J Imrnunol, 25, 2438-44. 42. Francis DA., Karras J.G., Ke X Y., Sen R. & Rothstein T.L. 1995. Induction of the transcription factors NF-kappa B, AP-1 and NF-AT during B ce12 stimulation through the CD40 receptor. Int Irnmunol, 7, 151-61. 43. Ren CL., Fu S.M. & Gehu RS- 1994. Protein tyrosine kinase activation andprotein kinase C translocation are functional components of CD40 signal transduction in resting human B cells. hmunol h e s t , 23, 437-48. 44. Inui S., Kaisho T.,Kikutani H., Stamenkovic 1,Seed B., Clark E.A- & Kishirnoto T. 1990- Identzfzcation of the intracytoplasrnic region essential for signal transduction through a B cell activation molecule, CD40. Eur J lmmunol, 20, 1747-53. 4.5- Paulie S., Rosen A-, Ehlin-Henrihson B., Braesch-Andersen S., Jakobson E., Koho H. & Perlmann P. 1989. The human B lymphocyte and carcinoma antigen, CDw40, is a phosphoprotein involved in growth signal transduction. Jlmmunol, 142, 590-5. 46. Nakano H., Oshima W., Chung W., Williams-Abbott L., Ware C.F., Yagita W. & Okumura K. 1996. T M F5,an activator of NF-kappaB and putative signal transducerfor the Zpphotoxin-beta receptor. JBiol Chem, 271, 14661-4. 47. Cheng G. & Baltimore D. 1996. T M K , a CO-inducerwith TRAF2 of TNF- and CD 401-mediafedNF-kappaB activation. Genes Dev, 10, 963-73. 48. Ishida T., Kobayashi N., Tojo T.,Ishida S., Yamamoto T. & Inoue J. 1995. CD40 signaling-mediated induction of B c l - . , Cdk4, and Cdk6. Implication of their cooperation in selective B cell growth. J Immunol, 155, 552 7-35. 49- Hu H M . O'Rourke K.Boguski U S . & Dixit Y.M. 1994. A novel RLVG finger protein interacts with the cytoplasmic domain of CD4O. J Biol Chem, 269, 30069-72. 50. Durie F. IL., Foy T.M . Masters S R . , Laman J.D. & Noelle R.J. 1994. The role of CD40 in the regdation of humoral and cell-mediated immunity. Immunol Today, 15, 406-1 1. 51. Sutherland C-L,Heath A. W., Pelech S.L., Young P.R & GoId M R 1996. Dzrerential activation of the ERK, m . and p38 mitogen-activated protein kinases by CD40 and the B cell antigen receptor. Jhrnunol, 157, 3381-90. 52. Sakata AL, Patel H.R. Terada N., Aruffo A., Johnson G.L. & Gelfand E. W. 1995. Selective activation of c-Jzm kinase mitogen-activated protein kinase by CD40 on human B cells. J Biol Chem, 2 70, 30823-8. 53. h u e J., Ishida T.,Tsukamofo N., Kabayashi N., Naito A., Anrma S. & Yamamoto T. 2000. Tumor necrosis factor receptor-associatedfactor ( T W )family: adapter proteins thnt mediate cytokine signaling. ET CeIl Res, 254, 14-24. 54. Mosialos G., Birkenbach M., YaZamanchiIi R., VanArsdale T ,Ware C. & Kieff E. 1995. The Epstein-Barr virus transforrning protein LMPI engages signaling pro teinsfor the turnor necrosisfactor receptorfamily. CeU, 80, 389-99. 55. Pullen S.S., Dang T.T.,Crute JJ. & Kehry MR. 1999. CD40 signaling through tumor necrosisfactor recepfor-associatedfactors (TR4Fs). Binding site speczJ9city and activation of downstreum pathways by distinct T W s . J Bi02 Chem, 274, 14246-54. 56. Sutherland C.L., Krebs D L . & GoId M. R. 1999. An I 1-amino acid sequence in the cytoplasmic domain of CD40 is suflcient for activation of c - h n N-terminal kinase, activation of MPKrtP kinase-2, phosphorylation of l kappa B alpha, and protection of WEHI-231 celh fi-om anti-lgM-induced growth arrest. J hrnunol, 162, 4 720-30. 57. Leo E., Zapata J.M. & Reed J.C. 1999. CD4O-mediated activation of lg-Cgamrnal- and Ig-cepsilon germ-line promoters involves multiple T M Ffamily proteins. Eur J Immunol, 29, 3908-13. 58. Lee H H., Dempsey P. W., Parks T.P., Zhu X., Baltimore D. & Cheng G. 1999. Specificüies of CD40 signaling: involvement of TRAF2 in CD4O-induced NF-kappaB activation and intercellular adhesion molede-1 up-regulation. Proc Nat1 Acad Sci U S A, 96, 1421-6. 59. Grammer A.C., Swantek JL., McFarland RD, Miura K, Geppert T. & Lipsky P.E. 1998. TNF receptor-associated factor-3 signaling mediates activation of p38 and Jun Nterminal kinase, cytokine secretion, and Ig production following ligation of CD40 on human B cells. JImmunol, 161, 1183-93. 60. Ishida T.K., Tojo T.,Aoki T.,Kobayashi A?, Ohishi T., Watanabe T., Yamamoto T. & Inoue J. 1996. TRAF5, a novel tumor necrosis factor receptor-associated factor family protein, mediates CD40 signaling. Proc Natl Acad Sci U S A, 93, 943 7-42. 61- Kashiwada M., Shirakata Y., houe JI,,Nakano H,, Okazaki K., Okumura K., Yamarnoro T.,Nagaoka H. & Takemori T. 1998. Tumor necrosis factor receptur-associated factor 6 ( T ' 6 ) stimulates extracellular signal-reguZated kinase (ERK) activity in CD40 signaïing along a ras-independentpathway. J JExp Me4 18 7, 23 7-44. 62. Hanissian S.H. & Geha R.S. 1997. Jak3 is associated with CD40 and is critical for CD40 induction of gene expression in B cells. Immzmity, 6, 3 79-87. 63. Jabara H H , Buckley R.H., Roberts J.L., Leflanc G., Loiselet J., KhaliZ G. & Geha R.S. 1998. Role of JRK3 in CD40-mediated signaling. Blood, 92, 2435-40. 64. Morio T.,Hanissian S.H., Bacharier L.B., Teraoka H , Nonoyama S., Seki M., Kondo J , Nakano H., Lee SKI Geha R.S. & Yata J. 1999. Ku in the cytoplasm associates with CD40 in human B cells and translocates into the nucleusfollowing incubation with IL-4 and antiCD40 mQb. Imrnunïîy, 11,339-48. 65. Gires O.,Zimber-Sfrobl U., Gonnella R., Ueflng M , Marschall G.,Zeidler R., Pich D. & Hammerschmidt W- 1997. Latent membrane protein 1 of Epstein-Barr virus rnimics a constitutively active receptor rnolecule. Embo J 16, 6131-40. 66. Arpin C., Dechanet J., Van Kooten C., Merville P., Grouard G., Briere F., Banchereau J & Liu Y.J. 1995. Generation of memory B cells andplasma cells in vitro. Science, 268, 7202. 67. Silvy A., Lagresle C., Bella C. & De#ance T. 1996. The d$firentiation of human memory B cells into specific antibody-secreting cells is CD40 independent. Eut J Immunol, 26, 5 I 7-24. 68. Bergman MC., Athep J.F., Grammer A.C. & Lipsky P.E. 1996. Ligation of CD40 influences the function of human Ig-secreting B ce11 hybridomas both positively and negatively. JImmunol, 156, 3118-32. 69. Valentine M.A. & Licciardi K.A. 1992. Rescue j?om anti-IgM-induced programmed cell death by the B cell surface proteins CD20 and CD40. Eur Jlmmunol, 22, 3141-8. 70. Tsubata T., Wu J. & Honjo T. 1993. B-cell apoptosis induced by antigen receptor crosslinking is blocRed by a T-cell signal through C m .Nature, 364, 645-8. 71. Choi M X , Boise L.H., Gottschalk A.R., Quintans 1,Thompson C.B. & Klaus G.G. 1995. The role gfbcl-XL in CD40-mediated rescuefiom anti-mu-induced apoptosis in WEHI231 B Zymphorna cells. Eur Jlmmunol, 25, 1352-7. 72. Nakayuma KI, Dustin LB.& Loh D.Y. 1995. T-B cell interaction inhibits spontaneous apoptosis of mature lymphocytes in Bcl-2-de_ficientmice. J Exp Med, 182, 1101-9. 73. Malisan F., Briere F., Bridon LM., Harindranath N., Mills F.C., Max E. E., Banchereau J: & Martinez-Valdez W.1996. Interleukin-IO induces immunoglobulin G isotype switch recornbination in hurnan CD40-activated naive B lymphocytes. J Exp Med. 183, 93 74 774 van Kooten C. & Banchereau J: 2000. CD4O-CD40 ligand. JLeukoc Biol, 67,247. 75. Notarungelo L.D. h Peitsch M.C. 1996. CD4Olbase: a database of CDIOL gene mutations causing X-linked hyper-IgM syndrome. Immunol Today, 17, 511-6. 76. Van Kooten C. & Banchereau L 1996. CD40-CD40 ligand: a multifunctional receptor-ligandpair. Adv Immunol, 61, I - 77. 77. Foy T.M., Aruflo A., Bajorath J., Buhlmann J E . & Noelle R.J. 1996. Immune regdation by CD40 and its ligand GP39. Annu Rev Immunol, 14, 591-61 7. 78. Kamanaka M., Yu P., Yasui T., Yoshida nt, Kawabe T., Horii T., Kishimoto T. Kikutani H. 1996. Protective role of CD40 in Leishmania major infection ut hvo distinct phases of cell-mediafed irnmuniîy. hmunity, 4, 275-81. 79. Campbell K A . , Ovendale P.J., Kennedy M X . , Fanslow W.C., Reed S.G. & Maliszewski C.R 1996. CD40 ligand is required for protective cell-mediated irnrnuniîy to Leishmania major. Immunim 4, 283-9. 80. Soong L., Xu J.C., Grewal LX, Kima P., SunJ., Longley B.J., Jr., RuddZe N.H., McMahon-Pratt D. & Flavell R.A. 1996. Disruption of CD40-CD40 ligand interactions results in an enhanced susceptibility to Leishmania arnazonensis ir$iection. Immunity, 3, 26373. 81. Durie F.H., Fava R.A., Foy T.M., Aruflo A., Ledbetter J.A. & Noelle R.J. 1993. Prevention of collagen-induced arthritis with an antibody to gp39, the ligand for CD40. Science, 261, 1328-3082. Mohan C., Shi Y., Laman LD. & Datta S.K. 1995. interaction between CD40 and ifs ligand gp39 in the development of murine lupus nephritis. J Immunol, 154, 1470-80. 83. Gerritse K., Laman J.D., Noelle R.J., Amffo A., Ledbetîer LA., Boersma W.J. & Cluassen E. 1996. CD40-CD40 ligand interactions in experimentul allergic encephalomyelitis and multiple sclerosis. Proc Nat1 Acad Sci U S A, 93, 2499-504. 84. Durie F. H.. Aruffo A., Ledbetter J., Crassi KM., Green W.R., Fast L.D. & Noelle R.J. 1994. Antibody to the ligand of CD40, gp39, blocks the occurrence of the acute and chronic forms of gruft-vs-host disease. J Clin Invest, 94, 1333-8. 85. Buhlmann J.E., Foy T.M., Amffo A., Crassi K M , Ledbetîer LA., Green W.R., Xu J.C., Shultz L.D., Roopesian D., FlavelZ R.A. & et al. 1995. In îhe absence of a CD40 signal, B cells are tolerogenic. Imrnunity, 2, 645-53. 86. Majno G. & Joris 1. I995. Apoptosis, oncosis, and necrosis. An oveniiew of cell deuth [see comment$ Am JPathol, 146, 3-15. 87. Thompson E.B. 1998. Special topic: apoptosis. Annu Rev Physiol, 60, 525-32. 88. Adams LM. & Cory S. 1998. The Bcl-2 protein family: arbiters of cell survival. Science, 281, 1322-6. 89. Lopez-Hoyos M., Carrio R., Merino J. & Merino R. 1998. Regulation of B ceZZ apoptosis by Bcl-2 and BcZ-XL and its role in the development of autoimmune diseases (Reviav). Int J Mol Med, 1, 475-83. 90. Nunez G., Merino R., Simonian P.L. & Grillot DA. 1996. Regulation of Zyrnphoid apoptosis by Bcl-2 and Bcl-XL. Adv Exp Med Biol, 406, 75-82. 91. Kroemer G., Dallaporta B. & Resche-Rigon M. 1998. The mitochondrial deatmijie regulator in apopîosis and necrosis. Annu Rev Physiol, 60, 619-42. 92. Green D. R. & Reed f,C. 1998. Mitochondria and apoptosis. Science, 281, 130942. 93. Kidd V.J. 1998. Proteolytic activities that rnediate apoptosis. Annu Rev Physiol, 60, 533-73. 94. Thornberry N A . & Lazebnik Y: 1998. Caspases: enemies within. Science, 281, 1312-6. 95. Wilson M R. 1998. Apoptosis: unmasking the executioner. CeZl Death Difler, 5, 646- 52. 96. Stroh C- & Schulze-Osthoff K. 1998. Death by a thousand cuts: an ever increasing list of caspase substrates [editorial]. Cell Death Dzffer, 5, 997-1000. 97. Earnshm WX., Martins L M . & Kaufinann S.H. 1999. Marnmaliun caspuses: structure, activation, subsîrates, and funcrions during apoptosis [In Process Citation]. Annu Rev Biochem, 68. 383-424 [IMEDLAlE record in processj. 98. Alam A., Cohen L. E, Aouad S. & Sekaly R.P. 1999. Early activation of casposes during T lymphocyte stimulation results in selective substrare clemage in nonupoptotic celZs [see comments]. J Eqv Med, 190, 1879-90. 99. Ashkenazi A. & Dixit ?J M. 1998. Death recepturs: signaling and moduIation Science, 281, 1305-8. 100. Walczak H. & Krammer P. H. 2000. The CD95 (APO-I/Fas) and the T'AIL (APO-2L) apoptosis systems. Exp Cell Res, 256, 58-66. 101. Nagata S. 1998.Fas-induced apptosis- Intern Me4 3 7, 1 79-81. 102. Rath P.C. & Aggawal B.B. 1999. TNF-induced signaling in apoptosis. J Clin Imrnunol, I9,350-64. 103. Mugnusson C. & Vaux D. L. 1999. Signalling by CD95 and TNF receptors: not on& l f e and death. Imrnunol Ce11Biol, 77, 41-6. 104. Golstein P. 1997. Cell death: TRAIL and its receptors. Curr Biul, 7, R750-3. 105. Funakoshi S., Longo DL., Beckwith M., Conley D.K., Tsarfaîy G., Tsarfaty 1, Armitage R.J., Fanslow W.C., Spriggs M. K & Murphy W.J. 1994. Inhibition of human B-cell Zymphorna growth by CD40 stimulation. Blood, 83, 2787-94. 106.- Marches R., RaciZa E., Tucker T.F., Picker L., Mongini P., Hsueh R., Vitetta ES.. Scheuerrnann R.H. & (Thr J.W. Y.995- Turnour dormancy and ce22 signalling--III: Role of hypercrosslinking of IgM and CD40 on the induction of cell cycle arrest and apoptosis in B Iymphoma ceZZs. Ther ImrnunoZ. 2, 125-36. 107. Pellat-Deceunynck C.,Amiot M., Robillurd N., Wijdenes J. & Bataille R. 1996. CD11a-CD18 and CD102 interactions mediate human myeloma cell growth arrest induced by CD40 stimulation. Cancer Res, 56, 1909-16. 108. Bergamo A., Bataille R. & Pellat-Deceunynck C. 1997. CD40 and CD95 induce programmed cell death in the human myeloma cell line XG2. Br J Haernatol, 9 7, 652-5. 109. Hess S. & Engelmann H. 1996. A novel jùnction of CDIO: induction of cell dedh in transfoormed cells. J Exp Med, 183, 159-67. 110. Garrone P., Neidhardt E.M, Garcia E., Galibert L., van Kooten C. & Banchereau J: 1995. Fas ligation induces apoptosis of CM-activated human B lymphocytes. J EXT,Med, 182, 1265- 73. 111. Schattner E.J., Elkon KB., Yoo D.H., Tumang J., Krammer RH., Crow M K . & Friedman S.M. 1995. CD40 ligation induces Apo-I/Fm expression on human B lymphocytes andfacilitates apoptosis through the Apo- I/Fas pathway. J Ejrp Med, 182, 1557-65. 112. Grell M , Zimmermann G., Gotwied E., Chen C.M., Grunwald U., Huang D. C., Wu Lee Y X , Durkop H , Engelmann H., Scheurich P., Wq-antH. & Strasser A. 1999. Induction of celZ dearh by tumour necrosisfactor W F ) receptor 2, CD40 and C m : a role for TNF-RI activation by endogenous membrane-anchored W F . Embo J, 18, 3034-43. 113. French R-R, Chan H.T., Tutt A L di Glennie M.J. I999, CD40 antibody evokes a cytotoxic T-ce11 response that eradicates lymphoma and bypasses T-cell help. Nat Med, 5, 548-53. 114. Leveille C., Zekki H , Al-Daccak R. & Mourad W. 1999. CD40- and HU-DR-mediated cell death pathways share a lot of similarities but d@er in their use of ADP-ribosylhansferase activities- Int Immunol, 11, 719-30, 115. Segui B., Andrieu-Abadie N., Adam-Klages S., Meilhac O., Kreder D., Garcia Y , Bruno A. P.,Jafiezou J.P., Salvayre R-, Kronke M. & Levade T. 1999. CD40 signals apoptosis through FAN-regulated activation of the sphingomyelin-ceramidepatbay. J Biol Chern, 2 74, 3 7251-8. 116. Koopman G R C.P.K.G.A.K R M. P.S. T.v.0.M. H. 1994. Annexin Vfor f2ow cytometric detection of phosphatidylserine expression on B cells undergoing apoptosis. Blood., 84, 141520. 11 7. Di Pietro R., Santavenere E.,Centurione L., Stuppia L., Centurione M A . , Vitale M. & Rana R. 1997. TNF-alpha-induced apoptosis in Daudi cells: rnultipararnetric analysis. Cytokine, 9, 463-70. 118. Baccam M. & Bishop G.A. 1999. Membrane-bound CD154, but not CD4O-specz2c antibody, mediates NF-kappaB-independent I L 6 production in B cells. Eur J Immunol, 29, 3855-66. 119. Pound J. D., Challa A., Holder M J , Armitage R.J., Dower S.K., Fanslow W.C., Kikut~niH., Paulie S., Gregory C.D. & Gordon J 1999. MNiimal cross-linking and epitope requirementsfor CD4O-dependent suppression of apoptosis contrust with those for promotion of the cell cycle and hornotypic adhesions in human B cells. Int Immunol, 11, 11-20. 120. Anderson P. 1997. Kinase cascades regulating entry into apoptosis. Micro biol Mol BioZ Rev, 61, 33-46. 121. Wang H , Grand R.J., MiZner A.E., Armitage R.J., Gordon J. & Gregory C.D. 1996. Repression of apoptosis in human B-LTymphoma cells by CD4O-ligand and Bcl-2: relationship to the cell-cycle and role of the retinoblastoma protein Oncogene, 13, 3 73-9. 122. An S. & ffiox KA. 1996. Ligation of CD40 rescues Ramos-Burkitt lymphoma B cells fiom calcium ionophore- and antigen receptor-triggered apoptosis by inhibiting activation of the cysteine protease CPP32LYama and cleavage of its substrate PARP. FEBS Lett, 386, 11522. 123. Kehry M.R. 1996. CD4O-mediated signaling in B cells. Balancing cell survival, growth, and death. Jlmrnunol, 156, 2345-8. 124. Braesch-Andersen S., Paulie S., Koho H , Nika H , Aspenstrom P. & Perlmann P. 1989. Biochernical characferisticsandpartial amino acid sequence of the receptor-like hurnan B cell and carcinoma antigen CDw4O. Jlmrnunol, 142, 562-7. 125. Tong A. K, Searnour B., Chen J., Su D., Ordonez G., Frase L.,Netto G. & Stone M.L 2000. CD40 ligand-induced apoptosis is Fas-independent in human multiple myeloma cells. Leuk Lymphorna, 36,543-58. 126. Pype S., Declercq W., Ibrahimi A., Michiels C., Van Rietschoten J.G., DewulfN., de Boer M ,Vandenabeele P., Huylebroeck D. & Remacle J , E. 2000. î T " P , a novel protein that associates wirh CD40,turnor necrosisfactor (ITNF)receptor-75 and TNF receptor-associated factors (TUFS),and rhat inhibits rruclear factor-kappa B activation. J Biol Chem, 2 75, 18586-93. 127. Force W-R., Cheung T.C. & Ware C.F. 1997. Dominant negative mutants of TRAF3 reveal an important role for the coiied coi1 domains in cell death signaling by the Zymphotoxin-beta receptor. J Bi01 Chem, 2 72, 30835-40. 128. Eliopoulos A. G., Davies C., Knox P. G., Gallagher NJ., Afford S.C., Adams D. H. & Young LIS. 2000. CD40 induces apoptosis in carcinoma cells through activation of cytotoxic ligands of the fumor necrosisfactor superfmily. Mol CeZl Biol, 20, 5503-15. 129. McCarthy J K, Ni J: & Dikit K M . 1998. HP2 is a novel NF-kappaB-activating and ce11 death-inducing kinase- J Bioi Chem, 2 73, 16968-75. 130. Kitanah C. & Kuchino Y. 1999. [Caspase-independent programmed ce21 death with necrotic morphoZogy]. Tanpakushitsu Kakusan Koso, 44, 2091400. 131- Lorenzo H.K., Szrsin S.A., Penninger J. & KToemer G. 1999. Apoptosis inducingfactor (AIF): a phylogenetically oZ4 caspase-independent effector of cell death. Cell Death Dzxer, 6, 516-24. 132. Kitanaka C. & Kuchino Y. i999. Caspase-independentprogrammed cell death with necrotic morphoZogy. Ce21 Death Dzffer, 6, 508-15. 133. Cuvillier O., E d d l L. & Spiegel S. 2000. Involvement of sphingosine in mitochondria- dependent Fas-induced apoptosis of type II JUI-katT cells. J BioZ Chem, 2 75, 15691- 700. 134. Jones B.E., Lo C R . , Srinivasan A., Valentino K.L. & Czaja M.J. 1999. Ceramide induces caspase-independent apoptosis in rat hepatocytes sensitized by inhibition of RNA synthesis. Nepatology, 30, 215-22. 3 Mengubas K., Fahey A.A., Lewin J., Mehta A.B., Hofirand A. V. & Wickremasinghe R.G. 1999. Kil2ing of T lymphocytes by synthetic cerarnide is by a nonapoptotic mechanism and is abrogatedfollowing mitogenic activation Exp Cell Res, 249, 116-22. 136. De Maria R., Lenti L.,Malisan F., d'Agostino F., Tomassini B., Zeuner A., Rippo Ad R. & Testi R. 1997. Requirement for GD3 ganglioside in CD95- and ceramide-induced apoptosis /jmbZished erratum appears in Science 1998 Apr 17;280(5362):363$ Science, 2 77, 1652-5137. Armour C.A., Eliopoulos A. G., Dawson C.W., Young L.S. & Wakelarn M.J. 1997. Involvement of cerarnide and JNK in CD4O-mediated growth inhibition. Biochern Soc Trans, 25, S.588. 138. Sanz L., Diaz-Meco M T.,Nakano H. & Moscat J; 2000. The ai-ypical PKC-interacting protein p62 channels NF-kappaB activation by the IL-1-TUF6 pathway. Embo J; 19, 15 76- 86. 139. Funakoshi S., Taub D.D., Asai O., Nirano A., Ruscetti F. W., Longo D.L. & Murphy W.J:1997. Eflects of CD40 stimulation in the prevention of human EB Y-lymphomagenesis. Leuk Lymphoma, 24, 187-99. 140. Baker M.P., Eliopoulos A. G., Young L.S., Amitage Rd,Gregory C.D. & Gordon J 1998. Prolonged phenotypic, finctional, and moleailm change in group 1Burkitt lymphoma cells on short-tem exposwe to CD40 ligand Blood 92,2830-43. 141. Goldstein M.D. d; Watts EH. 1996. Identification of distinct domains in CD40 involved in 87-1 induction or growth inhibition. J Irnmunol, I5 7, 283 7-43. 142. Sandberg M., Harnmerschmidt W- & Sugden B. 1997. Characterization of LMP-I 's association with TRAFI, TRAF2, and TRAF3. J ViroZ, 71, 4649-56. 4 3 Chaudhuri A., Orme S., Vo T., Wang R? & Cherayil B.J. 1999. Phosphoryhtion of T U F 2 inhibits binding to the CD40 cytoplasmic domain. Biochem Biophys Res Commun, 256, 620-5. 4 Liu Y., Liu KC., Meller N , Giampa L., Elly C., Doyle M. & Altman A. 1999. Protein kinase C activation inhibits tyrosine phosphorylation of CbZ and its recruitment of Src hornology 2 domain-containingproteim.J l m u n o l , 162, 7095-101.



![Pene_GrrrOH_02072015 - public [Mode de compatibilité]](http://s1.studylibfr.com/store/data/001230682_1-f593ab7310c23a44db266019e9363fd7-300x300.png)