33-Lupus systémique

!"#$$%&'(%
!
!
!
1!
&)%&*+*,%,-,./012*)%%
3*%&*+*,%'4-.5/06.)*7%(1,,/018/%9&'(:%
!
“!!"#$%&'()*+,#,-.(!de!cause!inconnue,!caractérisé!par!une!atteinte!systémique!et!par!une!évolution!
par!poussées!atteignant!un!ou!plusieurs!organes,!entrecoupé!de!rémissions!multiples!et!dont!le!
diagnostic!est!le!plus!souvent!confirmé!par!la!mise!en!évidence!d'anticorps!antinucléaires!”!
!
;< (/=181.138%
>6?6@1)%6*.3#100*8)%,-,./012*)!"#$#"%&$'(&)!*#$!+,!*-./0-$*1'(0)!'0*-$%#,%!2!"3)(%!+,)!
0#.#4')!',5.#00#%-'$)!"1$-,'6+)7!0+.%'5#"%-$')..)8!
!
9-,!&:-.+%'-,!()!5#'%!*#$!+3*,,/),<!
!
;)(!('<,)(!".','6+)(!(-,%!)((),%')..)0),%!2!
- $1+0#%-.-<'6+)(!
- 4)$0#%-.-<'6+)(!!
- ,&*1$-.-<'6+)(!
- =!*-+0-,(!)%!9>?!
;#!*$&(),")!@A68.1B34+,%68.18*B?/614)!)(%!'0*-$%#,%)!4#,(!.)!4'#<,-(%'"!4+!;@A8!
!
B06!2!;)!0-%!C!.+*+(!D!2!.-+*!),!.#%',7!#(*)"%!"#$#"%&$'(%'6+)7!),!5-$0)!4)!0#(6+)7!4)!
.3#%%)',%)!4+!:'(#<)!E!)%!C!&$/%1&0#%)+F!D!2!$-+<)!),!<$)"7!%$#4+'%!.#!"-+.)+$!$-+<)!4)!.3&$+*%'-,!
"+%#,&)8!!
C< '+1@/013?3D1)%
;)!;@A!)(%!.#!0#.#4')!(/(%&0'6+)!.#!*.+(!5$&6+),%)!#*$G(!.)!(/,4$-0)!4)!H-+<)$-%I!9JK<$),8!
• L$&:#.),")!2!MN!OP.#,"(Q!I!CEE%98314,:!R!MSS!SSS!1#P'%#,%(8!
• L.+(!&.):&!"1)T!.#!+3+*?6.138%8314)%).%?),%6,16.12*),!
• F4/@301868B)%=/01818)%2!U!5)00)(!R!M!1-00)!
• L'"!4)!5$&6+),")!),%$)!VSIWS!#,(8!
X'()!),!"#+()!4)(!<G,)(!Y;Z!4)!".#(()![[!2!(GC%).%(G$!
!
$< F5-,13+6.53?3D1)%
;)!.+*+(!()$#'%!4+!\!+,)!(),('P'.'%&!#""$+)!4)(!")..+.)(!\!.3#*-*%-()!O!(+$)0),%!4+)!#+F!]^7!
1-$0-,)(!()F+)..)(!5&0',',)(!-+!:'$+(!Q8!
=!XZ[!2!4&$G<.)0),%!4+!5-,"%'-,,)0),%!4+!(/(%!'00+,'%#'$)!
!
_,!#!6BB*0*?6.138%@)%B)??*?),%)8%6+3+.3,)!)%!)F*-('%'-,!43#,%'<G,)(!,+".&#'$)(!-+!
*1-(*1-.'*'4'6+)(8!
HB.1I6.138%@),%B)??*?),%100*81.614),%2!?-0+53B-.),%).%JFH!!
=!*$-4+"%'-,!#,-$0#.)!43[`>!α!
=!4/($&<+.#%'-,!4)!.#!$&*-,()!'00+,'%#'$)8!
Z0*.'5'"#%'-,!4)!.#!$&*-,()!'00+,'%#'$)!)%!#"%':#%'-,!4)(!;a!

!
2!
`-$0#%'-,!4)!"-0*.)F)(!'00+,(!
%(/+K.%@),%B)??*?),%)8%6+3+.3,)%).%@),%B30+?)7),%100*8,%6*%81I)6*%@*%4)18L%@),%64.1B*?6.138,%
).BM%
%
N< O6B.)*4,%+4/@1,+3,68.,%P%
%
I Q34038),%=/01818),%P!<$-(()(()!)%!"-,%$#")*%'-,!(%!4)(!5#"%)+$(!4&".),"1#,%!-+!#<<$#:#,%(!
I F4/@1,+3,1.138,%D/8/.12*),%%
I [,5)"%'-,!:'$#.)7!.)!(%$)((7!+,)!)F*-('%'-,!#+!(-.)'.!!!
I J)4.618,%0/@1B,%P!AI*&,'"'..#0',)7!"1.-$*$-0#T',)7!")$%#',(!#,%'"-,:+.(':#,%(7!bIP.-6+#,%(7!
0',-"/".',)!E!*)+:),%!4&".),"1)$!.)(!(/0*%c0)(!4+!.+*+(!2!-,!*#$.)!#.-$(!4)!.+*+(!C!',4+'%!D8!?)!
.+*+(!*)+%!4'(*#$#d%$)!\!.3#$$e%!4+!%$#'%)0),%8!!
%
R< J?1812*)%P%.4S,%+3?-034+5)%TT%
()*7%.-+),%@A6..)18.),%P%
I ],)!#%%)',%)!D/8/46?)!#:)"!2!Z@H7!5'G:$)7!#(%1&,')!)%!#,-$)F')!!(:%!('<,)(!43&:-.+%':'%&!
I ],)!#%%)',%)!I1,B/46?)!#:)"!2!#%%)',%)!64.1B*?614)7!@)406.3?3D12*)!-+!8/+543?3D12*)!
&)%@/U*.%+)*.%V.4)%P%
I +43D4),,1=%P!#**#$'%'-,!(+"")((':)!4)!*.+(')+$(!('<,)(!".','6+)(!
I -+!6,,)W%U4*.6?%P!4&".),"1&!*#$!+,)!)F*-!#+F!]^7!<$-(()(()7!',5)"%'-,7!%$#+0#!*1/('6+)!-+!
*(/"1'6+)7!0&4'"!
!
G02%P%#+"+,)!4)(!.&('-,(!6+'!:-,%!e%$)!"'%&)(!,3)(%!"-,(%#,%)!4#,(!.)!.+*+(%
%
N<; H..)18.),%64.1B*?614),%P%
@..)(!"-,")$,),%!XEY%@),%+6.1)8.,!
• Z$%1$#.<')(!-+!#$%1$'%)(!2!('<,)!','%'#.!.)!*.+(!5$&6+),%!
• A-+.)+$(!2!6+'!*)+:),%!e%$)!0'<$#%$'")(!)%!(-,%!(-+:),%!(/0&%$'6+)(!!
• A&5-$0#%'-,(!2!
$ Z'<+)(!-+!(+P#'<+)(!
$ H$-(()(!-+!0-/),,)(!#$%'"+.#%'-,(!
• (/018/46?1,6.138%/+1+5-,614)!(#,(!4)(%$+"%'-,!#$%'"+.#'$)!O4'#<!
4'55&$),%').!#:)"!.#!LZBQ!
• _(%&-,&"$-()(!#()*%'6+)(!
!
!)..)(!(-,%!5$&6+),%)(7!*-./0-$*1)(!)%!(:%!',#+<+$#.)(!
!
N<C H..)18.),%@)406.3?3D12*),%P%
?-,")$,),%!fSg!4)(!*#%'),%(!)%!(-,%!%$G(!&:-"#%$'")(!4)!.#!0#.#4')!
%

!"#$$%&'(%
!
!
!
3!
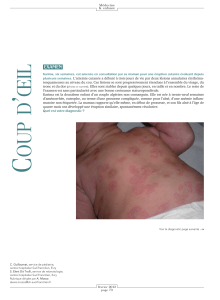
• H..)18.)%B646B./41,.12*)%P%/4-.5S0)%=6B16?7!0#"+.-I*#*+.)+F7!.&<G$)0),%!(6+#0)+F!)%!*#$5-'(!
h4&0#%)+F7!*$&(),%!#+!,':)#+!4)(!#'.)(!4+!,)T8!@,!5-$0)!4)!C!.-+*!D7!4)!0#(6+)!4)!"#$,#:#.!-+!
),!C!:)$*)(%'.'-!D8!?3)(%!*.+%c%!+,)!#%%)',%)!#'<+i8!
A3#+%$)(!&$+*%'-,(!"+%#,&)(!#**#$#'((),%!"-+$#00),%!(R!.)(!0#',(7!.)(!"-+4)(!-+!.)!4&"-..)%&7!#',('!
6+)!4)(!+."&$#%'-,(!P+""#.)!$-()(!)%!()!%$-+:),%!(+$!.)!:-'.)!4+!*#.#'(!-+!.)!,)T8!!
%
• H*.4),%6..)18.),%P%
o &*+*,%@1,B3Z@)%P%.&('-,(!&$/%1&0#%)+()(!*#*+.-I(6+#0)+()(!)%!P'),!
"'$"-,("$'%)(!2!.'0'%)(!,)%%)(!#:)"!+,!"),%$)!#%$-*1'6+)!O*.+%c%!#%%)',%)!
"1$-,'6+)Q%
o H?3+/B1)!"'$"-,("$'%)!),!*.#6+)!O*.+(!$#$)0),%!4'55+()!-+!"-0*.G%)Q%
%
• &/,138,%I6,B*?614),%[%4).)8.1,,)0)8.%B*.68/%P!!
$ (/,4$-0)!4)!B)/,#+4!
$ +."G$)(!
$ *+$*+$#!:#("+.#'$)!
$ !%1$-0P-()!
$ ,&"$-()!
!
;)(!.&('-,(!"+%#,&)(!(-,%!*#$5-'(!4&".),"1&)(!-+!#<<$#:&)(!*#$!.3)F*-('%'-,!(-.#'$)!!
.-"#.'(#%'-,!"#$#"%&$'(%'6+)!(+$!.)(!W38),%+53.3,%)7+3,/),%P!:'(#<)7!4&"-..)%&7!0#',(!
!
;#!P'-*(')!"+%#,&)!*)$0)%!.#!$)"1)$"1)!),
!
4!
.)+"-"/%+$')!
$ L#$5-'(!*#$!+,!I/41.6U?)%,-8@430)%8/+543.12*)!O(+$%-+%!4#,(!.)(!5-$0)(!
)F%$#0)0P$#,)+()(Q8!
%
\-+),%@A6..)18.),%4/86?),%P%
$ .&('-,(!<.-0&$+.#'$)(!0','0)(!O%/*)!MQ!!
$ <.-0&$+.-,&*1$'%)!0&(),<'#.)!O%/*)!VQ!!!
$ <.-0&$+.-,&*1$'%)!()<0),%#'$)!)%!5-"#.)!O%/*)!WQ!!!
$ <.-0&$+.-,&*1$'%)!*$-.'5&$#%':)!4'55+()!O5-$0)!.#!*.+(!(&:G$)Q!O%/*)!lQ!!
$ <.-0&$+.-,&*1$'%)!)F%$#0)0P$#,)+()!O%/*)!NQ!!
$ <.-0&$+.-,&*1$'%)!#:)"!(".&$-()!4'55+()!O%/*)!fQ!
!
]8%+)*.%3++3,)4%@)*7%=340),%@)%8/+543+6.51)%P%%
• &6%+4)01S4)%),.%?1/)%[%*8%+43B),,*,%18=?6006.314)%18.)8,)%P%
$ $)(*-,(#P.)!43+,)!,&*1$-*#%1')!<.-0&$+.#'$)!$#*'4)0),%!*$-<$)((':)!
$ *-+:#,%! "-,4+'$)! ),! .3#P(),")!4)! %$#'%)0),%! \! .3',(+55'(#,")! $&,#.)! %)$0',#.)! ),!
6+).6+)(!()0#',)(!-+!6+).6+)(!0-'(!!
• &6%@)*71S0)%=340)%),.%@A/I3?*.138%B543812*)%P%
$ .'&)!\!4)(!*-+((&)(!(+"")((':)(!
$ 4&<$#4#,%!"1#6+)!5-'(!+,!*)+!*.+(!.#!5-,"%'-,!$&,#.)8!
%
&6%D46I1./%@)%?6%8/+543+6.51)%+)*.%V.4)%,*,+)B./)%,*4%@),%@388/),%B?1812*),%).%U13?3D12*),%P%%
$ 1/*)$%),('-,!#$%&$')..)!43#**#$'%'-,!$&"),%)!
$ *$-%&',+$')!'0*-$%#,%)!2!mM<RJ!
$ *$&(),")! 43+,)! 1&0#%+$')! #((-"'&)! \! 4)(! "/.',4$)(! 1&0#%'6+)(! )%! \! +,)! .)+"-"/%+$')! (#,(!
',5)"%'-,!+$',#'$)7!4&<$#4#%'-,!$#*'4)!4)!.#!5-,"%'-,!$&,#.)8!!
$ .A6++641.138%@A*8%,-8@430)%*418614)%P%5/06.*41)L%^%?)*B3B-.*41)L%^%+43./18*41)!
$ Z%%)',%)!$&,#.)!$#*'4)0),%!*$-<$)((':)!
!
!9)+.)!.#!P'-*(')!$&,#.)!*)$0)%%$#!43),!*$&"'()$!.#!,/I/41./!)%!.)!+4383,.1B%2!)..)!)(%!J+(%'5'&)!4G(!
6+3'.!)F'(%)!4)(!#,-0#.')(!P'-.-<'6+)(!+$',#'$)(!',)F*.'6+&)(!
!
@,:'$-,!VS!\!WS!g!4)(!,&*1$-*#%1')(!.+*'6+)(!&:-.+),%!:)$(!.3',(+55'(#,")!$&,#.)!"1$-,'6+)!4#,(!+,!
4&.#'!4)!N!\!MS!#,(8%
%
N<N H*.4),%6..)18.),%P%
%
• H..)18.),%8)*43?3D12*),%P%
o 4+)(!#+F!%1$-0P-()(!2!9LZ;!!!
o 0#'(!#+(('!#+F!Z"!2!0/&.'%)(7!#%%)',%)(!,&:$'%'6+)(!)%"88!!
o ?&*1#.&)(!!
o L.+(!$#$)!"-,:+.('-,(7!+,)!*#$#./(')!%$#,('%-'$)!-+!4)(!0-+:)0),%(!#,-$0#+F!
o A&*$)(('-,7!"-,5+('-,!)%!4)(!*$-P.G0)(!4)!0&0-'$)8!
o n$G(!$#$)0),%!2!*(/"1-()!!
!
• H..)18.),%+*?038614),%P!%-+F7!4/(*,&)7!*.)+$&(')(7!5'P$-()(!!
%

!"#$$%&'(%
!
!
!
5!
!
• H..)18.),%B64@162*),%P!!
o *&$'"#$4'%)(7!0/-"#$4'%)(!!
o [,(+55'(#,")!"-$-,#$'),,)!
o n$-+P.)!4+!$/%10)!
o YnZ!
!
• _-8@430)%@),%68.1+53,+53?1+1@),%P!#:)"!%1$-0P-()(!:)',)+()(!-+!#$%&$')..)(!$&*&%&)(!
!
• \43*U?),%@1D),.1=,%P!!
o $#$)(!"#(!2!1&*#%'%)7!*#,"$&#%'%)7!*&$'%-,'%)!
o !1&*#%-0&<#.')!)%R-+!(*.&,-0&<#.')!*-(('P.)!
!
R (16D83,.1B%
%
R<; J41.S4),%@)%B?6,,1=1B6.138%@)%?AHJG%%
(16D83,.1B%+3,1.1=%,1%P!#+!0-',(!l!"$'%G$)(!(+$!MM!
!
!
!
R<C (16D83,.1B%B?1812*)%%
9)+.(!W!('<,)(!".','6+)(!(-,%!$&:&.#%)+$(!4+!.+*+(!O!43#+%#,%!*.+(!('!'.(!(-,%!#((-"'&(!Q!2!
I ;)(!#%%)',%)(!"+%#,&)(!
I ;)(!#%%)',%)(!#$%'"+.#'$)(!
I ;)(!#%%)',%)(!$&,#.)(8!
!
!
!
!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%