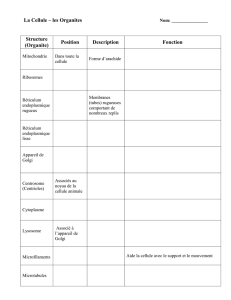
06/10/15 GAVAZZA Sophie L2 CR : Orianne Dodier Bases

!"#"$#%
&&'(
%
I. Définitions
)*+,*-./01.2*+*13+45+.-67583*+9*::4:78-*+;<:8283<+,7-+45*+1*4:*+2*2=-75*>+
?:+*13+,-<1*53+;751+3.43*1+:*1+9*::4:*1+75827:*1+*3+@<6<37:*1A+174B+:*1+<-03C-.903*1+D6:.=4:*1+-.46*1E>+
?:+*13+,7-3894:8F-*2*53+7=.5;753+;751+;*4/+30,*1+9*::4:78-*1+G+
• !"(CR : qui sont spécialisés dans la désintoxication)
•!##$#!"%&#&#!"%'(#!"%D9*::4:*1+;*1+34=4:*1+-<574/E>+
?:+5*+,.11F;*+,71+;*+6<5.2*+*3+;.59+,71+;HIJK>
II . Historique
LMNO)* -<7:81*+:H8;*538B89738.5+4:3-7P13-4934-7:*+;*1+,*-./01.2*1+Q4H8:+;<9-83+9.22*+;*+,*3831+9.-,1
9*::4:78-*1+7,,*:<1+R+S&
J751+ :*1+ 755<*1+ TUA +:H<Q48,* +;* +,- # + -<7:81*+ :7+ 97-793<-81738.5+ =8.9C828Q4* +;*1+ ,*-./01.2*1
V#W!#XYZ[
•"#\"]Y% ^&
•"#^"#&
+,*-./01.2*1+1.53+97-793<-81<1+,7-+:7+!#&
_5+`abTA+:7+9C7c5*+9.2,:F3*+;*+:7+dP./0;738.5+*13+8;*538B8<*+;751+:*1+,*-./01.2*1+;*+B.8*+;*+-73>+
I. Définition
II. Historique
!
" #
$ %

]YZ#WZ #e !"ZZf ]##&
LZ# g"!ZZfe#"L&
&
(\%## !hf%i]YZ&
LZ###hW\Zf%ZZfO\Z## "ZiOW #
]YZ#\ #%]YZ&
]#! %i./0
'"## "]YZVej[#! % Z10
"Y#i f"#!Y#&
\%"]YZ# "]#% 234 # 2356 hW" #
ZZf#"# Z#!&
•$'!h#!Z k#ZO#!"]V$Ll[&
•$'!h"W!Z mk#ZO#!"]nV$Lln[&
Y#iZ \Z## "
]YZ # " !Z]
Z"## g" WW # "
# ZZf#Z#!&
Exemple : Importation des protéines
matricielles.

"
(Y!!]YZ ]##O"W!&
]YZ"#!"#"]&
!'
!
(Y""Z#!]YZ&
]Y#Zg" Z #fZg"g"!#fZY&
L"#\"]Y% ^&
#" !g""o\]Y#"##\"]Y% "#
]Y&
LZ# #]W!#O!"o#!#!"VWO[&
Exemples des fonctions métaboliques chez l'Homme
78
•!Y#g"&
98
•I98;*1+6-71+p+':"%#(;$!!qVONO[&
•!#g"Oe#\]Y#\!Y#g"&
•!!f]Yg"VZfZ[&
<=+)7+283.9C.5;-8*+*13+1,<987:81<*+;751+:H./0;738.5+;*1+9C7c5*1+9.4-3*1A+2.0*55*1+*3+:.564*1A+r41Q4Hp+stt>+?:+0
7+9..,<-738.5+*53-*+:*1+283.9C.5;-8*1+*3+:*1+,*-./01.2*1>
()*+,-./.0123*4+53*06/0433789:+53*;
•u053CF1*+;*1+,:7127:.6F5*1+D*3C*-,C.1,C.:8,8;*1E+*5+9..,<-738.5+7@*9+:*+v_>
•u053CF1*+;*1+853*-2<;878-*1+;*1+1*:1+=8:878-*1+*5+9..,<-738.5+7@*9+:*+903.1.:A+:7+283.9C.5;-8*A+:*+v_>+
•Y#i!%#V^O!!g"[&
•u053CF1*+;4+9C.:*13<-.:+*5+9..,<-738.5+7@*9+:*+903.1.:+*3+:*+v_>+
j

<8+3=5254:+53*06>0?@)43=)@:+/D2<37=.:812*+;H798;*1+7285<1E>+
A
•w/0;738.5+;*+:H798;*+,8,<9.:8Q4*+D798;*+7285<E>
•J<6-7;738.5+;*1+,-.1376:75;85*1>+
•J<6-7;738.5+xV!#[&\^*13+,-.;483+*3+;<6-7;<+;751+9*3+.-67583*+D9737:71*E>+
•#]Y#&
"#
(Y#%"#%
k W"#f%i]YZ
• W"###e!##"#W!#"]YZ&
• W"# !#WV]ZWW!##!!$'"Z#[&
k W!# !#W W!#]YZ&
jk YZg"]YZV !ZZ# !#OWW!#\ %#O!#!#OW[&
>!%"(%?!"%#;&!"%@$&%!$A!(%"!%?A!#!'%!(%'&?!%'(#!B%((#!B%-0
C#$"%#!"%" DED!"%"(%'!"B%#$"%#%D#?&!%!"%;'A!F%
G*80
1. Maladies résultant d'un déficit dans la biogenèse du peroxysome :
$]YZ%V$[&
ZV1[WW!###"#eZ #fg""]YZ&
L"e# "#\Z#g"Z"##""Zj%i$Ll!"&
(\%#]Z
k"%""YZy%VWW!##e%i$Ll[&
k!YXZ g"!#" V$[g"WW!#$Lln&
2 . Maladies résultant d'un déficit d'une seule enzyme peroxysomale :
ZWW!##% ""eZ #fg"&
(\%#]Z
•\1*1HI/0
•\"# W!#z]Y#&
•ZW"Z"#&
•\" W!#Y#iZ%i&
•\" W!#"Z #fZ"%Y]#&
3 . Maladies résultant d'un déficit de la dynamique du peroxysome ( fission/ élongation ) :
• W!#$(
• W!#$Llz
N

$%
&{ Z#|##J0
&(e#%#+*JW"f%g"V\]###"g"[&
j&WZ#" W!# #"+*J"Wff#
•]#W!#]YZ&
N&!# #1" W!#
•##!Z Z##"Wff#
•!%%i]""e##"e
&
L##"]Z #"Z #fZO#" ! Z#"%"#%
Z !"!Z]V#iZ%"O"g"##Z"!%O
%Y!Y## #Z]YZ[&
Z#WW #!!# #g"
•\Y!" !!#&
•Z e"Z}Z&
•YZ #%#! !Wg"&
•(Y"Z#!# "#g"V##Z#[&
1 . présentation clinique des maladies peroxysomales :
Z]YZ#!!#
•##YZg""!~OW!#"g"##&
••###"%g"VY# # eiO! #O!| O"#
g"O#"fZ!O"!Y#[&
••###!"#""# &
•YW!#Z# #g"#%#k##"]&
••# eZ#&
L"e# #"#WZ!g"
•### #&
•###W# !!&
•###"#e&
2 . Investigations biochimiques - bilan de première intention :
e#%##"f"#\]#!W!#"]YZ&"#
•!%h#i%"!V'[Vz]Y#[N&
•\!Y#g"V€]Y#[g" e\Z##VY#[&
•\!#g"Vz]Y#[g" e"\Z##&
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%