DIALOGUE PASSIONNEL DE L`URANYLE AVEC SES LIGANDS

LA FEUILLE ROUGE - N° 563 mai 2010
Comité de rédaction : E. Molva, J. Planès (DIR), P. Dalmas de Réotier (SPSMS), L. Dubois (SCIB), S. Lyonnard (SPRAM),
G. Prenat (SPINTEC), R. Vallcorba (SBT), P. Warin (SP2M) - Mise en page : M. Benini (DIR) tél. 04 38 78 36 33
INSTITUT NANOSCIENCES ET CRYOGÉNIE
Commissariat à l’Énergie Atomique - Direction des Sciences de la Matière - Centre de Grenoble - inac.cea.fr/feuille_rouge
Le cation uranyle est composé d’un ion
uranium central, lié de part et d’autre à deux
ions oxygène, et présente une forme de bâton-
net. Comme des sites de coordination restent
vacants autour de l’uranium dans le plan per-
pendiculaire, celui-ci peut s’associer avec divers
ligands pour former des complexes d’uranyle
dont la charge globale varie selon l’état d’oxy-
dation de l’uranium : (VI) ou (V). Dans le milieu
naturel, l’uranium existe sous deux formes majo-
ritaires : l’uranyle(VI) soluble, et l’uranium(IV)
en général insoluble. Cependant les composés
uranyle(V) interviennent dans les processus de
réduction (milieu biologique ou minéral) des
espèces (VI) vers les espèces (IV). Ils participent
donc à travers la précipitation de l’uranium(IV)
à l’accumulation de cet élément dans certains
compartiments écologiques.
Pourtant les composés de l’uranyle(V) sont
très mal connus en raison de leur instabi-
lité intrinsèque qui se manifeste par une réac-
tion dite de dismutation : 2U
V
→U
VI
+ U
IV
.
Au cours de cette réaction, deux uranyle(V) réa-
gissent l’un sur l’autre pour former un uranyle(VI)
et un uranium(IV). Récemment les chimistes du
SCIB ont réussi à bloquer cette réaction et à sta-
biliser des complexes uranyle(V) ouvrant la voie
à une étude systématique de ces composés.
Pourquoi dans ces complexes particuliers
l’uranyle(V) est-il si stable ? Traditionnellement,
l’uranyle(V) est perçu comme un cation capable
d’interagir avec les ligands uniquement via des
liaisons ioniques (électrostatiques). Aussi, une
des hypothèses avancées est que les complexes
stables sont tellement encombrés, qu’il leur est
impossible d’interagir ensemble pour échanger
leur électron. Pour en avoir le cœur net, les théo-
riciens du SCIB ont réalisé des calculs de DFT
(théorie de la fonctionnelle densité), avec un
résultat étonnant à la clef : l’uranyle(V) est capa-
ble de former des liaisons covalentes, et encore
mieux de donner lieu à de la rétrodonation π
(voir encart). Ces résultats surprenants sont liés
à la nature électronique particulière des ligands
utilisés : un phénolate, très riche en électrons qui
va « enrichir » l’uranyle(V) en densité électroni-
que, et une pyridine qui au contraire va récupé-
rer une partie des électrons de l’uranyle(V). Ce
dialogue entre ligand donneur et accepteur via
l’ion uranyle(V) stabilise suffisamment ce dernier
pour lui couper l’envie de se dismuter.
Sur ces nouvelles bases, les chimistes du
SCIB sont en train de mettre au point de nou-
veaux complexes uranyle(V) afin d’explorer
et de comprendre la réactivité singulière de
ce cation. Le prochain défi des théoriciens est
alors de comprendre le mécanisme précis des
réactions de dismutations. Ces
deux approches complémentaires
pourraient déboucher à terme
sur une meilleure compréhension
des mécanismes de dispersion de
l’uranium dans le milieu naturel,
améliorer le stockage en profon-
deur des déchets nucléaires et
le développement de stratégies
plus efficaces de dépollution
(mines, armements, stockage du
combustible). La précipitation de
l’uranium(IV) intervenant égale-
ment lors du retraitement industriel
des déchets, la connaissance des
mécanismes liés à sa formation
permettra d’optimiser ces procé-
dés.
Contact : Valentina Vetere - SCIB - [email protected]
chimie théorique
DIALOGUE PASSIONNEL DE L’URANYLE AVEC SES LIGANDS
Le cation uranyle(V) UO
2
+
joue un rôle très important dans la chimie de l’uranium. Il intervient notamment au cours de processus biologiques ou
encore comme élément perturbateur dans le retraitement des déchets nucléaires. Cependant ces composés restent en général extrêmement difficiles
à étudier car instables. En se basant sur des résultats expérimentaux récents, une équipe du SCIB a pu modéliser de tels composés. Les résultats
obtenus permettent d’envisager de nouvelles voies pour obtenir des composés uranyle(V) stables.
La rétrodonation π
A l’instar des humains, les métaux M et
les ligands L peuvent établir plusieurs types de
liaisons. La première que l’on pourrait qualifier
de « platonique » est la liaison ionique : les
espèces se lient via des interactions électros-
tatiques à travers l’espace (cas du chlorure de
sodium). La seconde liaison plus «physique»,
dite covalente, où le métal et le ligand mettent
leurs électrons en commun grâce au recouvre-
ment de certaines de leurs orbitales selon une
symétrie axiale (équivalent à une liaison simple
en chimie organique, de type σ). Ces liaisons
covalentes peuvent également se décliner sous
une forme «passionnée», où, éventuellement en
plus d’une liaison σ, les partenaires échangent
leurs électrons via des orbitales localisées de
part et d’autre de l’axe les reliant (double liaison
de type π). Pour ces liaisons π, les électrons
peuvent être préférentiellement localisés sur le
métal (ligand π donneur) ou sur le ligand (ligand
π accepteur). Dans ce dernier cas, tout se passe
comme si le métal redonnait de la densité élec-
tronique au ligand, d’où le terme rétrodonation.
Lorsqu’un métal possède plusieurs ligands de
nature différente (nous arrêterons la comparai-
son avec les humains à ce point), une synergie
peut apparaître entre un ligand donneur L2 et un
ligand accepteur L1, le centre métallique servant
d’intermédiaire.
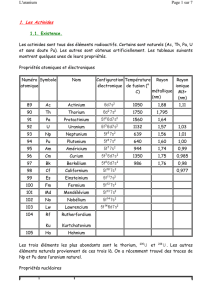
Calcul DFT des orbitales moléculaires d’un complexe uranyle(V). Les
boules vertes représentent les atomes d’azote, les rouges les atomes
d’oxygène, les volumes bleus et jaunes représentent les orbitales mo-
léculaires du complexe. A) cas d’une liaison ionique, l’uranium
U
n’a
pas d’échange avec ses ligands pyridine, et on observe une orbitale
atomique de l’uranium de type f. B) rétrodonation π, les orbitales
moléculaires de type π de la pyridine se recouvrent avec les orbitales
atomiques de type f de l’uranium.
1
/
1
100%