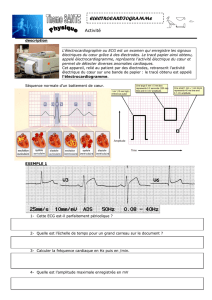
acquisition et optimisation du logiciel neuroscan

GOMBERT FLORENCE
GB03
Stage TN09
CNRS UMR 7593 : Vulnérabilité, Adaptation et
Psychopathologie
(directeur : Prof. R. Jouvent)
ACQUISITION ET OPTIMISATION DU LOGICIEL NEUROSCAN
D’ELECTROENCEPHALOGRAPHIE DANS UN PROTOCOLE
EXPERIMENTAL PRECIS

2
REMERCIEMENTS
Je tiens tout d’abord à remercier la Pédagogie de l’UTC qui permet à ses étudiants une
expérience professionnelle de longue durée au cours de ses études. Celle-ci est primordiale, extrêmement
pertinente et déterminante dans la construction et l’élaboration d’un cursus. Enrichissante confrontation.
Je remercie le professeur Roland JOUVENT, directeur de recherche, de m’avoir accueillie dans
son laboratoire. Sa vivacité, sa pertinence, son opportunité intellectuelle, son dynamisme et sa capacité à
faire interagir les disciplines sont d’une extrême motivation pour tout son entourage. C’est une force de
travail et d’innovation.
Je remercie tout particulièrement Stéphanie DUBAL, chargée de recherche, suiveuse de stage.
Grâce à sa qualité de chef d’équipe j’ai pu saisir l’importance du travail individuel à visée collective. Sa
gestion humaine et délicate a permis une répartition claire des objectifs et le travail pertinent de chacun.
Travailler à ses cotés a suscité un enseignement explicite : théorique, pratique et scientifique, mais bien
plus un enseignement implicite et une attitude scientifique : rigoureuse, vive, dynamique, volontaire,
pertinente, plastique, adaptable et spécifique. Je la remercie de sa générosité.
Je remercie également Chantal PEROT, suiveuse de l’UTC pour sa présence durant tout le stage,
pour son intérêt pour mon travail et son déroulement, mon évolution, ainsi que pour sa disponibilité et son
tutorat.

3
SOMMAIRE
SOMMAIRE..................................................................................................3
RESUME TECHNIQUE................................................................................5
INTRODUCTION..........................................................................................6
I. PRESENTATION........................................................................................................8
II. LES POTENTIELS EVOQUES : METHODES D’EXPLORATION FONCTIONNELLE
DE L’ACTIVITE CEREBRALE........................................................................................11
A. R
APPELS THEORIQUES
:.................................................................................................... 11
1 - Electroencéphalographie.............................................................................................................................11
2 - Les potentiels évoqués .................................................................................................................................12
3 - la P300.........................................................................................................................................................13
B. E
LECTROGENESE
..............................................................................................................14
1 - Genèse des potentiels électriques ................................................................................................................14
2 - Analyse microscopique................................................................................................................................15
3 - Modèle dipolaire..........................................................................................................................................15
C. T
ECHNIQUE D
’
ACQUISITION ET DE TRAITEMENT
...................................................................17
1 - Acquisition...................................................................................................................................................17
2 - Amplification et référence............................................................................................................................18
3 - Filtrage........................................................................................................................................................20
4 - Le moyennage..............................................................................................................................................20
5 - Cartographie, Interpolation, Projection......................................................................................................20
D. L
E
M
ATERIEL ET SON
O
RGANISATION
.................................................................................23
1 - Le système de recueil des signaux : le casque.............................................................................................24
2 - Les boites têtières :......................................................................................................................................25
3 - Le système de stimulation : STIM................................................................................................................26
4 - Le système d’amplification et de digitalisation : Syn Amps, et le système d’acquisition et d’analyse des
données : SCAN.....................................................................................................................................................27
III. LE PROTOCOLE EXPERIMENTAL ........................................................................30
A. L
E
P
RE
-
TEST
....................................................................................................................30
1. Pertinence et Hypothèses.............................................................................................................................30
B. P
ROGRAMMATION DU TEST
................................................................................................32
1 - Hiérarchie du logiciel de stimulation STIM................................................................................................32
2 - Les paramètres de test/la configuration ......................................................................................................33
3 - Les images...................................................................................................................................................35
4 - La randomisation.........................................................................................................................................37
5 - Création des fichiers séquentiels.................................................................................................................38
IV. LES ENREGISTREMENTS......................................................................................41
A. _N
UMERISATION CRANIENNE ET ELECTRODES
.....................................................................41
1 - FASTRAK : Numérisateur ...........................................................................................................................42
2 - 3D Space Dx................................................................................................................................................42
3 - Etapes de numérisation du sujet..................................................................................................................43
B. C
REATION DU
SET
UP
FILE D
’
ACQUISITION
.........................................................................44
C. L
ES ENREGISTREMENTS
:
A
PPROCHE
,
P
RATIQUE ET
F
AMILIARISATION AVEC LE LOGICIEL
......50

4
V. TRAITEMENT DES SIGNAUX.................................................................................52
A. E
TAPES DE TRAITEMENT
:..................................................................................................52
1 - Correction de la ligne de base :...................................................................................................................53
2 - Rejet des artefacts : .....................................................................................................................................53
3 - La réduction de l’artéfact de mouvement oculaire......................................................................................53
4 - Moyennage des tracés..................................................................................................................................54
5 - Filtrage des signaux : (FILTER) .................................................................................................................55
6 - Dérivation linéaire (linear Detrend)...........................................................................................................55
B. A
UTRES
M
ETHODES DE MOYENNAGES
................................................................................55
1 - FSP average ( pour SNR faible)..................................................................................................................55
2 - Bande de puissance/ Cohérence des événements liés (Event related band power/coherence)....................56
C. L
OCALISATION DE SOURCES
...............................................................................................56
1 - SCD / Interpolate.........................................................................................................................................57
2 - Filtre spatial (Spatial Filter) .......................................................................................................................58
3 - Filtre spatial à décomposition des valeurs singulières (SVD).....................................................................58
D. C
ARTOGRAPHIE
................................................................................................................58
1 - GFP / Reference ..........................................................................................................................................58
2 - 2D Mapping.................................................................................................................................................59
3 - 2D cartooning..............................................................................................................................................59
4 - Spectrum Mapping.......................................................................................................................................59
5 - 3D space......................................................................................................................................................60
E. A
NALYSES STATISTIQUES
...................................................................................................60
1 - Coherence / Event related coherence (eeg).................................................................................................60
2 - Corrélation de Pearson et calcul de son coefficient r ( fichier eeg ou moyenné : avg)...............................60
3 - Corrélation croisée / intra corrélation croisée (après moyennage)...........................................................61
4 - Calcul du t-score apparié (avg)...................................................................................................................61
5 - t-score (avg).................................................................................................................................................61
6 - z-score (avg)................................................................................................................................................62
CONCLUSION............................................................................................63
ANNEXES..................................................................................................65

5
RESUME TECHNIQUE
Résumé technique :
Acquisition théorique et pratique de la technique d’exploration fonctionnelle
cérébrale électroencéphalographique. Acquisition et mise en place d’un nouveau logiciel
d’électroencéphalographie(Neuroscan) comprenant casque de recueil à 64 électrodes,
boîtes têtières de pré-amplification, amplificateur, logiciel d’acquisition et de traitement
des signaux, logiciel de présentation des stimuli. Il s’est agit de réaliser la programmation
d’un test de stimulation visuelle dans le cadre d’un protocole très précis, de traiter les
images pour la réalisation de ce test. Acquisition d’abord théorique du module
d’acquisition du logiciel, puis pratique via grand nombre d’essais visant à l’optimisation
des branchements et des paramètres d’acquisition pour le recueil optimal de signaux sur
tous les canaux du casque. Acquisition du module de pointe de traitement des signaux,
découvertes, recherches de ce domaine en pleine expansion. Réalisation d’un cahier des
charges des étapes de traitement dans le cadre précis de notre protocole et de nos
recherches.
Mots clés :
Exploration fonctionnelle cérébrale, électroencéphalographie, potentiels évoqués,
physiologie, capteurs, système de recueil et d’acquisition de données biomédicales,
traitement du signal, traitement des images, architecture et hiérarchisation, triggerring.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
1
/
83
100%