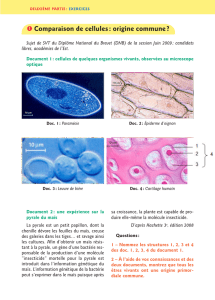
Vigicultures® Mode opératoire observation Maïs Parcelles fixes

Vigicultures_mais_complet_proc_v6_7mars12.doc 1/30
Attention : ce document imprimé ne correspond peut-être pas à la version en vigueur à ce jour.
La version en vigueur est sur le portail ou disponible chez le rédacteur.
Vigicultures®
Mode opératoire observation
Maïs Parcelles fixes complet
Doc de référence validé : 01_protocole harmonMaïs_VF_20110216.xls
Rédigé par : Danièle Simonneau, Josiane Lorgeou, Jean-
Baptiste Thibord, Philippe Crosson
vigicultures_mais_complet_proc
Version n°6
Date : 7mars12
Les modifications du document d’une version à l’autre sont repérées avec un trait dans la marge.
La version 6 concerne l’évolution de l’échelle de la méthode de notation globale (de 5 classes à des %) pour
certaines maladies foliaires, la modification des notations auxiliaires pour être homogène avec les autres cultures,
et modification de la notation « experts » dégâts de limaces.
SOMMAIRE
1.OBJET ET DOMAINE D’APPLICATION .............................................................................................................. 2
2.DEFINITIONS ET REFERENCES........................................................................................................................ 2
Les références indispensables .................................................................................................................... 2
Pour aller plus loin ....................................................................................................................................... 2
3.MODE OPERATOIRE. ......................................................................................................................................... 2
Définition des parcelles fixes et zones d’observation : ............................................................................................ 2
Définition des observations flottantes : .................................................................................................................... 3
Suivis « Standard » et Suivis « Experts » : .............................................................................................................. 3
Lieux de suivis particuliers : ..................................................................................................................................... 3
Périodes de nuisibilité des principaux ravageurs et principales maladies ............................................................... 3
Déclinaison des Méthodes de suivi en fonction des bioagresseurs. ....................................................................... 4
4.COMMENT OBSERVER LES STADES ? ............................................................................................................ 6
5.COMMENT NOTER LES RAVAGEURS ? ........................................................................................................... 7
Ravageurs des jeunes Maïs les plus fréquents ....................................................................................................... 7
Ravageurs des jeunes Maïs moins fréquents ........................................................................................................ 11
Foreurs ................................................................................................................................................................... 13
Au printemps (et une seconde fois en juillet-aout pour les secteurs à 2 générations), suivi de la
nymphose ou chrysalidation des Pyrales et Sésamies. ..................................................................................... 13
Suivi des vols de papillons de Pyrale, Sésamie, Héliothis. Suivi conseillé par JBTH ............................... 13
Piège delta .......................................................................................................................................................... 15
Piège pot à entonnoir ......................................................................................................................................... 15
Suivi de la pression de la G1 (Pyrale et Sésamie) (méthode Nathalie Eychenne) ................................... 16
Suivi de l’activité de l’Héliothis ................................................................................................................... 16
Comptage des pontes de Pyrale ............................................................................................................... 17
Comptage des infestations larvaires avant récolte Suivi conseillé par JBTH ............................................ 17
6.COMMENT NOTER LES MALADIES ? ............................................................................................................. 18
Maladies principales ............................................................................................................................................... 18
Autres maladies : ................................................................................................................................................... 20
7.COMMENT NOTER LES VIROSES ? ............................................................................................................... 23
8.COMMENT NOTER LES AUXILLIAIRES ? ....................................................................................................... 23
9.Les ONR ............................................................................................................................................................. 23
10.ANNEXES ...................................................................................................................................................... 24

Vigicultures_mais_complet_proc_v6_7mars12.doc 2/30
Attention : ce document imprimé ne correspond peut-être pas à la version en vigueur à ce jour.
La version en vigueur est sur le portail ou disponible chez le rédacteur.
1. OBJET ET DOMAINE D’APPLICATION
Les objectifs assignés aux réseaux d’épidémiosurveillance sont :
Editer des Bulletins de Santé du Végétal pour limiter les traitements phytosanitaires aux seules situations
où ils sont indispensables : pressions parasitaires et dépassement des seuils de nuisibilité dans la logique
d'Ecophyto 2018.
Connaître l’état de la pression des bioagresseurs en fin de campagne.
Ce mode opératoire décrit les méthodes d’observations à mettre en œuvre sur les différents bio-agresseurs du
Maïs évalués sur les parcelles fixes dans Vigicultures. Ce protocole d’observation comprend aussi les notations
fusariose et dégâts de foreurs. Ces observations ne feront pas l’objet de cartes de risques dans Vigicultures.
Suivant la consigne du groupe harmonisation des protocoles grandes cultures :
La liste des bioagresseurs à suivre est laissée à l'appréciation des comités régionaux, sur proposition de
l'animateur régional du réseau pour ne retenir que les bioagresseurs suffisamment significatifs dans sa région.
Pour aider les comités régionaux, afin d’obtenir une cohérence nationale, les critères suivant sont à prendre en
compte :
- Prévalence historique d’un organisme sur un territoire donné et de son potentiel de nuisibilité pour la
culture. Il conviendra de considérer également des organismes dont le retour est occasionnel comme les criquets
ou les lépidoptères phytophages (héliothis, vanesse, cirphis).
- Réalisation éventuelle d’une intervention avec un produit phytosanitaire soit directement (année
d’observation) soit d’intervention en différé (observation intégrée au niveau régional dans le choix des traitements
des semences ou micro granulés au semis, du type fusariose du blé, mouche du choux du colza, taupins du maïs
ou sur tournesol.
- Pour les organismes règlementés, la mutualisation de l’information n’est pas retenue comme la procédure
adéquate, en cas de soupçon de présence, il sera procédé à une information directe du SRAl concerné.
- Evolutions possibles dans le parasitisme observé dans une région. Soit ces bioagresseurs possibles ou
probables seront pris en compte en début de campagne, soit l’animateur régional se donnera les moyen de les
inclure rapidement dans les listes s’il est constaté une évolution l’année en cours (ex : signalements en
observations flottantes ou dans les commentaires).
2. DEFINITIONS ET REFERENCES.
Les références indispensables
Adresse du portail Internet Vigicultures : http://www.vigicultures.fr
Le protocole harmonisé maïs validé par la DGAl : 01_protocole harmonMaïs_VF_20110216.xls
Les fiches de saisie des observations (disponibles sur le portail).
Les méthodes d’observation (disponibles sur le portail).
Repérer les Stades de croissance et de développement du Maïs - avril 2002 (disponible sur le portail).
Pour aller plus loin
Grille de diagnostic des accidents Maïs
Diagno-LIS® service internet pour accompagner le diagnostic des accidents.
Brochure « les ravageurs du Maïs » AGPM 1996
3. MODE OPERATOIRE.
Définition des parcelles fixes et zones d’observation :
Selon les réseaux, il a été défini de suivre des zones traitées ou non avec les produits foliaires.
Concernant les agresseurs habituellement traités à l’aide des traitements de semences, il est intéressant d’effectuer des suivis
sur des parcelles sans TS insecticides.
Selon le choix du réseau, il est possible de préserver une zone non traitée foliaire jusqu’à la fin de la végétation, en ayant à
l’esprit qu’elle accentuera les phénomènes de la pratique (environ 100m*100m dimension multiple de la largeur du pulvé pour
éviter de parcourir toute la parcelle de l’agriculteur).
Si le choix est à l’inverse, suivre une zone d’observation sur la parcelle jusqu’au premier traitement foliaire, après ce premier
traitement suivre cette zone en ayant bien enregistré les interventions. Elle sera représentative de la pratique agricole.
Afin d’équilibrer le réseau, le groupe national « harmonisation des protocoles grandes cultures » propose que la proportion de
parcelles non traitées (foliaires) devrait être aux environs de 10 à 20% (bornes : 0-50) de la totalité des parcelles du réseau. Un
ajustement est possible régionalement.
Dans tous les cas, il est important d’indiquer dans vigicultures la liste des traitements appliqués sur la zone observée, y compris
les traitements de semences.

Vigicultures_mais_complet_proc_v6_7mars12.doc 3/30
Attention : ce document imprimé ne correspond peut-être pas à la version en vigueur à ce jour.
La version en vigueur est sur le portail ou disponible chez le rédacteur.
Définition des observations flottantes :
Concernant un certain nombre de parasites, des relevés ponctuels « observations flottantes » peuvent être effectués. Ils
permettent de repérer l’arrivée d’un bio agresseur et ainsi d’alerter tout le réseau. Les observations peuvent être ensuite selon
l’opportunité et l’intérêt poursuivi sur cette parcelle qui deviendra alors fixe.
Suivis « Standard » et Suivis « Experts » :
Pour se conformer aux orientations données par le groupe « harmonisation des protocoles grandes cultures », les méthodes de
notations « standard » portent en général sur l’observation de 20 plantes pour les dégâts sur feuilles et de 25 plantes pour les
dégâts racinaires et foliaires ou pour les maladies racinaires. Il est possible de prévoir un suivi « standard » ou un suivi
« experts » selon les bioagresseurs, les moyens et la qualification du réseau.
Lieux de suivis particuliers :
Certaines observations spécifiques, limitées dans le temps, sont réalisées sur des lieux qui peuvent être géo référencés sans
être nécessairement assimilables à des parcelles fixes, notamment lorsque les autres observations d'un suivi de parcelle ne
sont pas réalisées tout au long de la culture comme prévu régionalement. On peut citer par exemple, les pièges lumineux et les
cages à maturation des femelle de papillons pour le maïs, les capteurs d'ascospores du phoma, les kits fleurs sclérotinia ou les
dissection de femelles de charançons lorsqu'ils sont réalisés sur des parcelles surnuméraires par rapport au réseau de
parcelles fixes pour le colza, … Néanmoins dans certains cas les données acquises sont en partie dépendantes des
paramètres agronomiques de la parcelle sur laquelle les dispositifs sont situés, notamment en terme de précédents et
d’attractivité, paramètres qui seront alors renseignés.
Périodes de nuisibilité des principaux ravageurs et principales maladies

Vigicultures_mais_complet_proc_v6_7mars12.doc 4/30
Attention : ce document imprimé ne correspond peut-être pas à la version en vigueur à ce jour.
La version en vigueur est sur le portail ou disponible chez le rédacteur.
Déclinaison des Méthodes de suivi en fonction des bioagresseurs.
Variable Stade Deb.Stade Fi
n
Suivi standard Suivi Experts
Stade du Maïs SEMIS_NL recgr Liste déroulante texte
Corvidés ou autres oiseaux SEMIS_NL 8F Liste déroulante texte : 5 classes
Géomyze SEMIS_NL 8F Liste déroulante texte : 5 classes
Oscinies SEMIS_NL 10F Liste déroulante texte : 5 classes
Mouche des semis L3F 4F Liste déroulante texte : 5 classes
Tipules SEMIS_NL 8F Liste déroulante texte : 5 classes
Vers gris Luperina Noct terricoles SEMIS_NL 8F Liste déroulante texte : 5 classes
Taupins SEMIS_NL 10F Liste déroulante texte : 5 classes
Scutigerelle SEMIS_NL 10F Liste déroulante texte : 5 classes
Nématodes SEMIS_NL 10F Liste déroulante texte : 5 classes
Limaces dégâts sur plantes L3F 6F Liste déroulante texte : 5 classes Pourcentage
Cicadelle Verte 4F 21F Liste déroulante texte : 0 ou n°de feuille Pourcentage
Puceron metopolophium dirhodum L3F grd Liste déroulante texte : 0 / 1-10 / 11-50 / 51-100 / 101-500/ >500 puc par plte
Puceron sitobion avenae L3F grd Liste déroulante texte : 0 / 1-10 / 11-50 / 51-100 / 101-500/ >500 puc par plte
Puceron Rhopalosiphum padi panicule Flm grd Pourcentage Pourcentage
Puceron Rhopalosiphum padi Epis Flm grd Pourcentage Pourcentage
Altise petite SEMIS_NL 6F Liste déroulante texte : 5 classes
Courtilière SEMIS_NL 6F Liste déroulante texte : 5 classes
Pucerons des racines 6F Fl15 Liste déroulante texte : 5 classes
Blaniules et autres Iules SEMIS_NL 10F Liste déroulante texte : 5 classes
Hépiale SEMIS_NL 10F Liste déroulante texte : 5 classes
Hanneton Vers blancs SEMIS_NL 10F Liste déroulante texte : 5 classes
Clivina Carabe du Maïs L3F 4F Liste déroulante texte : 5 classes
Noctuelles defoliatrices, Lépidoptères defoliateurs 8F grp Liste déroulante texte : 5 classes
Acariens N° dernier étage foliaire touché 8F recgr Liste déroulante texte : 0 ou n°de feuille
Acariens %pieds touchés 8F recgr Pourcentage
Acariens %pieds touchés 8F recgr Pourcentage
Acarien F1 à F21 % attaque 8F recgr Pourcentage
Héliothis nb papillons Phéromone L3F Grlp Numérique
Pyrale nb papillons Phéromone L3F Grlp Numérique
Sésamie nb papillons Phéromone L3F Grlp Numérique
Pyrale nb adultes pièges Lumineux L3F Grlp Numérique
Sésamie nb adultes pièges Lumineux L3F Grlp Numérique
Pyrale taux chrysalidation G1 et G2 SEMIS_NL 14F Pourcentage
Sésamie taux chrysalidation G1 et G2 SEMIS_NL 14F Pourcentage
Pyrale % plte av limbe coup de fusil 8F Grlp Pourcentage
Sésamies dégâts sur plantes L3F 12F Liste déroulante texte : 5 classes
Héliothis % ptes attaquées 8F Grlp Pourcentage
Pyrale % ptes attaquées 8F Grlp Pourcentage

Vigicultures_mais_complet_proc_v6_7mars12.doc 5/30
Attention : ce document imprimé ne correspond peut-être pas à la version en vigueur à ce jour.
La version en vigueur est sur le portail ou disponible chez le rédacteur.
Variable Stade Deb.Stade Fi
n
Suivi standard Suivi Experts
Pyrales nb total de pontes, nb nv pontes, nb pontes st tete noire, nb ponte ecloses, nb pontes
parasitées, nb pontes disparues L3F Grlp Numérique
Foreurs % pltes attaqués avt recolte Grlp recgr Pourcentage
Foreurs % attaques sous et au dessus epis avt recolte Grlp recgr Pourcentage
Foreurs % épis attaqués avt récolte Grlp recgr Pourcentage
Pyrale nb males nb femelles piege lumineux L3F Grlp Numérique
Pyrale nb adultes, nb mâles, nb femelles G1 et G2 cage L3F Grlp Numérique
Sésamie nb adultes G1 et G2 cage L3F Grlp Numérique
Helmintho fusiforme % pltes atteintes et % atq 3F sous l'épi et au dessus épi Flm grp Pourcentage
Helmintho fusiforme % pltes atteintes, % necrose 1eF, 2eF et 3eF sous epis et au dessus épi Flm grp Pourcentage
Fusariose épi indéterminée %pltes touchées Grlp grd Pourcentage Pourcentage
Fusa graminearum % pltes attaquées Grlp grd Pourcentage
Foreurs galeries/plte avant recolte (intensité) Grlp recgr Pourcentage
Foreurs nb galeries/plte avant recolte Grlp recgr Numérique
Fusa moniliforme % pltes attaquées Grlp grd Pourcentage
Héliothis nb larves/plte avant récolte Grlp recgr Numérique
Pyrales nb larves/plte avant récolte Grlp recgr Numérique
Sésamies nb larves/plte avant récolte Grlp recgr Numérique
Pythium sp L3F 8F Liste déroulante texte : 5 classes
Rhizoctone 8F recgr Liste déroulante texte : 5 classes
Pourriture molle Erwinia chrysanthemi 8F Grlp Pourcentage
Helminthosporiose moucheté H.carbonum Flm grp Pourcentage
Helminthosporiose maydis Flm grp Pourcentage
Kabatelliose Flm grp Pourcentage
Rouille Puccinia sorghii Flm grp Pourcentage
Anthracnose Flm grd Pourcentage
Coup de feu fusarien Flm grd Pourcentage
Mildiou Bilan Flm grd Pourcentage
Charbon commun ustilago bilan Flm grd Pourcentage
Charbon nu des inflorescences bilan Flm grd Pourcentage
Fusariose sur tige ou vasculaire Bilan Flm grd Pourcentage
Virose MRDV transmise par cicadelle Laodelphax L3F Fl15 Pourcentage
Virose commune, jaunisse BYDV Grlp grd Pourcentage
Viroses autres, mosaique MDMV 10F grd Pourcentage
Auxilliaires Coccinelles % pltes av larves, av adultes 8F Grlp Pourcentage
Auxilliaires Chrysopes % pltes av œufs, av larves 8F Grlp Pourcentage
Auxilliaires Syrphes % pltes av larves et pupes 8F Grlp Pourcentage
Auxilliaires Pucerons parasités % 8F Grlp Pourcentage
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%