Exercice n°1 : REACTIONS TOTALES ? 7 points

TS 3 rattrapage Devoir surveillé n°6 (2 heures ) Le 2- 02 - 10 NOM :
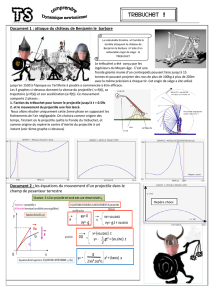
Exercice 1 : Le trébuchet (correction labolycée Réunion 2007)
Le trébuchet est une machine de guerre utilisée au Moyen Âge au cours
des sièges de châteaux forts. Le projectile pouvait faire des brèches
dans les murailles des châteaux forts situés à plus de 200 m du
trébuchet. Son principe de fonctionnement est le suivant :
Un contrepoids relié à un levier est maintenu à une certaine hauteur
par des cordages. Il est brusquement libéré. Au cours de sa chute, il
agit sur un levier au bout duquel se trouve une poche en cuir dans
laquelle est placé le projectile.
Lors de sa libération, le projectile de la poche se trouve à une hauteur H = 10 m et est projeté avec
une vitesse
0
V
faisant un angle avec l'horizontale (voir la figure 1 à remettre avec la copie).
Les mouvements du contrepoids et du projectile s'effectuent dans un champ de pesanteur uniforme.
Données :
Masse du projectile m = 130 kg.
Intensité du champ de pesanteur g = 9,8 m.s-2.
Hauteur du projectile au moment du lancer : H = 10 m.
Le système étudié est le projectile. Les frottements de l'air et la poussée d’Archimède sur le projectile seront
négligés dans cette étude. Le champ de pesanteur
g
est parallèle à l'axe Oz. La situation est représentée sur la
figure 1 à remettre avec la copie.
1. En appliquant la 2nde loi de Newton dans le cadre de la chute libre, déterminer les
coordonnées ax et az du vecteur accélération du centre d'inertie du projectile dans le repère
indiqué.
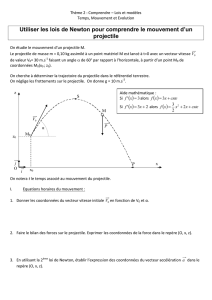
z
v0
Sol
x
H
O
Figure 1 :
Tir au trébuchet

2. Donner l'expression des coordonnées du vecteur vitesse initiale
v0
, notées V0X et v0z, en fonction de V0 et .
3. On appelle composante horizontale de la vitesse la coordonnée vx(t) du vecteur
v
et
composante verticale la coordonnée vz(t).
Déterminer l'expression des composantes horizontale et verticale vx(t) et vz(t) du vecteur vitesse
v
du
système au cours de son mouvement.
6. En déduire la nature du mouvement du projectile en projection sur l'axe horizontal. Justifier.
7. Déterminer l'expression des équations horaires du mouvement du projectile : x(t) et z(t).
8. Déterminer l’expression de l'équation de la trajectoire du projectile .
9. Quelle est la nature de la trajectoire du projectile ? Représenter qualitativement l'allure de
la trajectoire sur la figure 1 à remettre avec la copie.
10. En utilisant l'expression de l'équation de la trajectoire obtenue à la question 8., indiquer les
paramètres de lancement qui jouent un rôle dans le mouvement du projectile.
11. Dans le cas où le projectile est lancé avec une vitesse initiale horizontale, montrer que
l'abscisse de son point de chute sur le sol est : x =
H
v. g
0
2
12. Avec quelle vitesse initiale V0 horizontale, le projectile doit-il être lancé pour atteindre la
base du mur du château situé à une distance x = 100 m ?
Exercice 2 :. (Correction labolycée Polynésie 2005)
Les 2 parties de l’exercice sont indépendantes.
1. La solution aqueuse d’ammoniac
L'ammoniac, NH3 , est un gaz qui, dissous dans l’eau, donne une solution basique.
Des solutions d'ammoniac sont vendues dans le commerce. Ces solutions, après dilution, sont utilisées comme
produit nettoyant et détachant.
On se propose d'étudier quelques propriétés de l’ammoniac dissous puis de déterminer sa concentration dans
un de ces produits.
Données relatives à la partie 1 :
couple acide/base : ion ammonium NH4(aq)+ / ammoniac dissous NH3(aq)
constante d'acidité du couple ion ammonium/ammoniac à 25°C: Ka = 6,3 x 10-10,
produit ionique de l’eau à 25°C: Ke = 1,0 x10-14.
1.1. Produit ionique de l’eau.
Qu’appelle-t-on produit ionique de l’eau? Donner son expression.
1.2. Réaction de l’ammoniac avec l’eau
On prépare une solution S par dissolution dans l’eau d’une quantité de matière n d’ammoniac gazeux égal à
n = 2,5 x 10–3 mol. On obtient V = 250 mL de solution S de pH égal à 10,6.
1.2.1. a. Ecrire l'équation de réaction entre l’ammoniac dissous NH3(aq) et l’eau.
b. Ecrire l’expression de la constante d'équilibre de cette réaction en fonction du KA et Ke.
Calculer sa valeur.
1.2.2. a. Calculer la valeur du pKa du couple ion ammonium / ammoniac.
b. Tracer le diagramme de prédominance du couple ion ammonium / ammoniac en déduire l’espèce
prédominante dans S

1.2.3.
a. Calculer la concentration C en soluté ammoniac apporté dans la solution S.
b. Calculer la concentration en ion oxonium, H3O+ , dans la solution S.
c. En déduire la concentration en ion hydroxyde, HO– , dans la solution.
d. Montrer que le taux d'avancement final peut s'écrire =
[HO
_
]f
C
, puis le calculer.
(on pourra s’aider d’un tableau d’avancement)
e. Calculer le quotient de réaction Qr, f à l’état final et montrer que le système est à l’équilibre aux
incertitudes de mesures et de calcul près.
2. Détermination de la concentration en ammoniac d’une solution commerciale
2.1. Dilution de la solution commerciale
Afin de déterminer la concentration C0 d’une solution commerciale, on propose de réaliser un titrage acido-
basique de la solution commerciale. Celle-ci étant très concentrée, on fabrique par dilution, une solution S1 de
concentration c1 mille fois plus petite.
Parmi les lots de verrerie proposés, choisir, en justifiant par un calcul, celui que l'on doit utiliser pour réaliser au
mieux cette dilution.
Lot 1
Lot 2
Lot 3
Lot 4
Pipette jaugée 1 mL
Becher 1000 mL
Becher 50 mL
Pipette graduée 10 mL
Fiole jaugée 1 L
Becher 50 mL
Pipette jaugée 1 mL
Fiole jaugée 1 L
Becher 50 mL
Pipette jaugée 10 mL
Fiole jaugée 1 L
Becher 50 mL
2.2. Titrage acido-basique de la solution diluée.
On réalise un titrage pH-métrique de V1= 20,0 mL de solution diluée S1 par une solution d'acide chlorhydrique
(H3O+(aq) + Cl–(aq)) de concentration CA = 1,50 x 10-2 mol.L-1.
L'équation support du titrage est: NH3(aq) + H3O+(aq) = NH4+(aq) + H2O(I).
Pour obtenir l'équivalence il a fallu verser un volume V = 14,3 mL d'acide chlorhydrique.
On note que le pH à l'équivalence vaut 5,7.
a. Donner 2 caractéristiques pour qu’une réaction serve de support pour un titrage.
b. Établir la relation à l'équivalence entre C1, CA, V1, V où V est le volume de solution acide versé à
l'équivalence.
c. En déduire C1 puis C0.
d. Parmi les indicateurs colorés suivants, choisir, en justifiant, celui qui pourrait être utilisé pour réaliser
ce titrage de façon colorimétrique. Indiquer le changement de couleur qui serait alors observé.
Indicateur colore
Couleur forme
acide
Zone de virage
Couleur forme
basique
hélianthine
rouge
3, 1 – 4,4
jaune
Rouge de chlorophénol
jaune
5,2 – 6,8
rouge
Bleu de bromothymol
jaune
6,0 – 7 ,6
bleu
phénolphtaléïne
incolore
8,2 – 10
Rouge violacé
1
/
3
100%