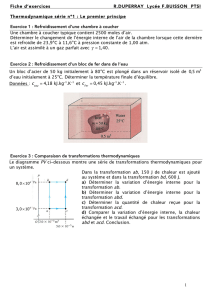
T - Free

1
5- Diagrammes d’équilibre
Diffusion, germination, croissance
a) Solutions solides et composés définis
b) Diagrammes de phases
c) Diagrammes de phases et microstructures
d) Cas particuliers
e) Détermination des diagrammes
f) Les transformations de phase

2
• Des combinaisons chimiques bien définies peuvent se former entre deux
métaux (ou entre un métal et non métal) par dissolution de ces éléments
dans le métal de départ. Si au cours de cette dissolution le réseau
métallique ne change pas on peut dire que l’on a introduit un soluté dans un
solvant. On parle alors d’une SOLUTION SOLIDE.
Cette introduction peut s’opérer par :
–Substitution : lorsque les atomes du soluté
B prennent la place d’atomes de A dans la
maille.
–Insertion : lorsque les atomes du soluté B
sont assez petits pour se loger dans les sites
interstitiels de la maille de la matrice A.
5-a Solutions solides et composés définis

3
• La substitution doit se produire sans provoquer une déformation notable pouvant
conduire notamment à une démixion (séparation en deux phases).
• Critères à prendre en compte (règles de Hume-Rothery 1899-1968) :
–type de structure cristalline.
–taille relative des atomes : (rsoluté-rsolvant / rsolvant) x 100 ≤ 15%.
–valence des deux éléments.
–électronégativité.
• En général, variation des paramètres cristallins : expansion/contraction du
réseau. Variation obéit à la loi de Vegard si linéaire avec le taux de la
substitution.
5-a Solutions solides et composés définis
Solution solide de substitution

4
• Solution solide d’insertion
–Atomes de faibles dimensions (atomes légers non métalliques) dans les
interstices du réseau métallique de base.
–rH=0,030 nm, rO=0,066 nm, rN=0,071 nm, rC=0,077 nm, rB=0,087 nm.
–Insertion dans les sites octaédriques ou tétraédriques.
• Composés définis :
Stables dans un étroit domaine de composition correspondant à une
stœchiométrie AxBy. Possèdent généralement une structure cristalline
différente de A et de B. Exemples : Cu3Al, TiC, Fe3C…
Structure Site ri (nm)
CFC, HC (ri octa > ri tétra) octaédrique 0,414 r
CC (ri octa < ri tétra) tétraédrique 0,291 r
5-a Solutions solides et composés définis
Solution solide d’insertion, composés définis

5
• Toutes parties de l’alliage possédant les mêmes propriétés physiques,
chimiques et la même composition appartiennent à la même PHASE (ϕ).
• Phase caractérisée par sa structure cristalline.
• Interface entre phase caractérisée par une énergie spécifique interfaciale
(J.m-2). Rôle important dans les transformations de phases et les mécanismes
de rupture des matériaux.
• Les alliages métalliques (C constituants) peuvent être étudiés comme des
systèmes physiques dont le nombre de degrés de liberté (variance) est
donné par :
Variance = C + 1 - ϕ(sous 1atm.)
• Paramètres d’équilibre : température et composition chimique des phases.
Un diagramme de phases rend compte de la constitution d’un alliage à
l’état d’équilibre thermodynamique.
5-b Diagrammes de phases
Notion de phase, variance
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%