D1_-_UE9_-_Dubus_-_Thyroide_podcast_3

UE9 – Hormonologie, Reproduction
Dr Dubus
Date : Année 2013-2014 Plage horaire : Podcast 03
Promo : DCEM1 Enseignant : Dr Dubus
Ronéiste :
PAYET Lisa
La thyroïde
I/ Introduction
1) Rappels anatomiques
2) Embryologie
3) Histologie
II/ Les thyréocytes
1) Synthèse de T3 et T4
2) Catabolisme de la thyroglobuline
3) Hypoactivité/hyperactivité
4) Les hormones T3 et T4
III/ Les cellules C
IV/ Régulation de l’activité
V/ Pathologies
1) Hyperthyroïdies
2) Hypothyroïdies
3) Cancers
I/ Introduction

1) Rappels anatomiques
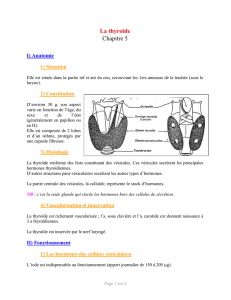
La glande thyroïde est une glande unique située à la face antérieure du cou, de part et d’autre de la trachée, devant
les premiers anneaux trachéaux. Elle est mobile avec la déglutition, palpable et pèse 15 à 20 g.
Elle a une forme de papillon, et est constituée de 2 lobes latéraux de 3cm de large sur 2cm d’épaisseur et 5cm de
hauteur. Ces deux lobes sont unis à leur face antérieure par une partie médiane, l’isthme, souvent surmontée par la
pyramide de Lalouette. Ils ne sont pas unis à leur face postérieure. L’isthme se situe en regard du 3ème cartilage
trachéal.
Rapports de la thyroïde : - Au-dessus : Cartilage thyroïde
- En arrière : Trachée
- En bas : Crosse de l’aorte
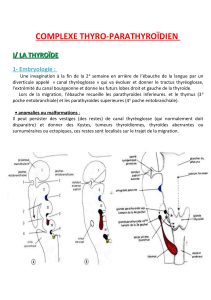
2) Embryologie
4ème semaine : La masse principale de la thyroïde va se former à partir de l’endoblaste, par l’intermédiaire d’une
invagination du plancher de l’intestin pharyngien formant le foramen caecum, puis le diverticule thyroïdien, et
ensuite le conduit thyréo-glosse. Ce conduit thyréo-glosse va se diviser en région distale pour former les deux lobes
thyroïdiens latéraux réunis entre eux par l’isthme.
L’endoblaste n’est pourtant pas le seul feuillet embryonnaire qui participe à la formation de la glande thyroïde.
Des cellules provenant des crêtes neurales vont migrer et rejoindre les corps ultimo-branchiaux en formant la 4ème
poche endobranchiale. Elles vont ensuite fusionner avec le conduit thyréo-glosse, conduisant à la formation de la
thyroïde primitive, où elles vont donner un sous-type cellulaire spécifique : les cellules C de la thyroïde.

3) Histologie
La thyroïde est délimitée par une fine capsule conjonctive vascularisée (vaisseaux sanguins et lymphatiques).
Cette capsule envoie des septas fibreux délimitant des lobules thyroïdiens. Toutefois, la délimitation est incomplète,
il n’y a pas de séparation totale des lobules.
Ces lobules sont constitués de vésicules ou follicules thyroïdiens, séparés par du tissu conjonctif lâche peu
abondant, très richement vascularisé (lymphatique et sanguin), riche en fibre de réticuline, composé également
de quelques fibroblastes et de fibres de collagène, et en temps normal, pauvre en cellules.
Dans certaines pathologies, on a une augmentation du contenu cellulaire (lymphocytes, plasmocytes…) du stroma
de la thyroïde, notamment en cas de thyroïdite (inflammation de la thyroïde). On peut aussi avoir une fibrose de ce
tissu conjonctif.
Ces vésicules ou follicules thyroïdiens sont l’unité fonctionnelle de la thyroïde. Ce sont des structures sphériques
de taille extrêmement variable, et qui ne sont pas forcément synchrones.
On peut donc avoir en même temps des vésicules en activité et d’autres au repos. Ils sont composés de :
- Une assise cellulaire épithéliale unique périphérique, composée essentiellement de thyréocytes (cellules
principales de la thyroide), parfois (pas toujours) associés à quelques cellules C (qui proviennent des crêtes
neurales). Ces thyréocytes vont être responsables de la production de colloïde (qui est une forme de stockage des
hormones thyroïdiennes T3 et T4). Cette colloïde va être produite, libérée et stockée dans la partie centrale de la
vésicule.
- Une lame basale, qui les limite extérieurement.
- Le fin stroma conjonctif vascularisé (capillaires sanguins et lymphatiques) et innervé qui les entoure.
Les cellules C sont plus claires et assez difficiles à voir par technique classique. Elles sont mises en évidence par
technique immunohistochimique avec des Ac dirigés contre l’hormone produite par ces cellules C : la calcitonine.
II/ Les thyréocytes

Les thyréocytes vont former un épithélium simple qui peut être, en fonction de l’état fonctionnel de la vésicule,
pavimenteux, cubique ou cylindrique. Ils vont participer à la synthèse des hormones T3 (Triiodothyronine) et T4
(Tétraiodothyronine ou thyroxine).
1) Synthèse de T3 et T4
1- Synthèse de la thyroglobuline et de la peroxydase à partir des acides aminés sanguins
Après stimulation par la TSH, les thyréocytes captent, par leur pôle basal, les AA des capillaires périphériques
nécessaires à la synthèse de la thyroglobuline et de la peroxydase. On a alors une synthèse classique par le REG,
puis une glycosilation au niveau de l’appareil de Golgi et enfin la formation de vésicules qui vont venir fusionner
avec la membrane cytoplasmique des thyréocytes au niveau des microvillosités de leur pôle apical. Cette exocytose
et la libération du couple thyroglobuline-peroxydase dans la colloïde permettent l’activation de la peroxydase.
2- Captation de l’iode minéral sous forme d’iodures par les thyréocytes
Il s’agit d’un dispositif particulier, caractéristique aux thyréocytes, responsable de la capture d’iode sous forme de
iodure sanguin. Par ailleurs, la thyroïde est l’organe dans lequel va s’accumuler l’iode.
3- Transformation en iode organique par la peroxydase avant d’être stocké dans la colloïde
Ensuite cet iode va être transformé en iode organique par l’intermédiaire d’une oxydation par la peroxydase.
4- Iodification de la thyroglobuline
Cet iode organique va ensuite se coupler à la thyroglobuline au niveau des villosités des thyréocytes pour iodifier
cette thyroglobuline et ainsi former des molécules de T3 et de T4 par modification des AA de la thyroglobuline.

Synthèse de la thyroglobuline Catabolisme de la thyroglobuline
2) Catabolisme de la thyroglobuline
1- Résorption de la colloïde
La thyroglobuline est la forme de stockage des hormones T3 et T4. Quand il y a un besoin de ces hormones, on
va avoir un catabolisme de cette thyroglobuline qui va être captée à la surface des thyréocytes par l’intermédiaire des
microvillosités qui vont former des vésicules de phagocytose.
2- Fusion avec les lysosomes
Ces vésicules de phagocytose fusionnent avec des lysosomes, ce qui conduit à la digestion de cette thyroglobuline
stockée dans la colloïde.
3- Digestion et libération : T3 et T4 (liposolubles)
Cette digestion aboutit à la libération d’AA iodés sous forme de T3 et de T4 qui sont devenus des AA
liposolubles. Ils vont donc pouvoir franchir librement les membranes biologiques et gagner la circulation sanguine
au niveau de laquelle ils sont couplés à des protéines de transport.
3) Hypoactivité/hyperactivité
- Hyperactivité :
Lorsqu’ils sont actifs, les thyréocytes ont une taille augmentée, une forme cylindrique ou prismatique haute, avec
une diminution de la colloïde au niveau central de la vésicule.
- Hypoactivité :
Lorsque les thyréocytes sont au repos, leur taille diminue et leur épithélium devient cubique ou aplati avec une
augmentation de la colloïde.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%