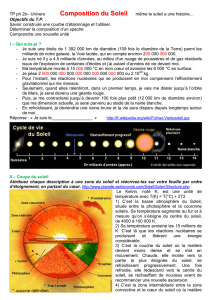
Spectroscopie Atomique et Profils de raies spectrales des transitions

Master Phys. de Rayonnement ; Spectroscopie et profils de raies spectrales ;
Prof. F. Khelfaoui ; Université de Ouargla (Décembre 2012) Page 1
Spectroscopie Atomique et
Profils de raies spectrales des transitions radiatives
I. Niveaux d’énergie de l’atome d’hydrogène et des ions hydrogénoïdes
suivant le modèle de Bohr
- Postulats de Bohr
2
0
1
8 2
p
T
E
e
Er
πε
= − =
pq pq q p
h E E
ω ν
= = −
h
- Niveaux d’énergie et rayons des orbites
2
0
2
n
Z E
E
n
= −
2
0
n
a n
r
Z
=
- Les séries radiatives (Lyman, Balmer, Pashen, …)
- Correction d’énergie due à la masse du noyau M : (masse réduite µ)
e
e
m M
m M
µ
=
+
II. Equation de Schrödinger pour les atomes et ions à un électron
1) Les axiomes de la mécanique quantique
2) Fonctions radiales, niveaux d’énergie et fonctions propres des états liés
3) Représentation spectroscopique
4) Transitions radiatives dans l’approximation dipolaire électrique : les règles de
sélection
III. Structure fine des ions hydrogénoïdes
1) Spin de l’électron et moment cinétique total
2) Moment dipolaire magnétique et interaction magnétique
3) Energie des ions hydrogénoïdes avec la structure fine
4 2
0
4
2 3
2 1 4
nj n
Z n
E E E
n j
α
= − −
+
α est la constante de structure fine et E0 est l’énergie d’ionisation de l’atome
d’hydrogène à partir de l’état fondamental (suivant Bohr). En représente l’énergie des niveaux
de ces ions suivant la résolution de l’équation de Schrödinger (égale à celle du modèle de
Bohr).
Le terme en Z4 est dû à :
- La correction d’énergie due à l’interaction spin-orbite
- La correction d’énergie due la masse relativiste
- La correction de Darwin
4) Diagramme d’énergie et transitions radiatives

Master Phys. de Rayonnement ; Spectroscopie et profils de raies spectrales ;
Prof. F. Khelfaoui ; Université de Ouargla (Décembre 2012) Page 2
5) Bases de données de physique atomique
http://physics.nist.gov/cgi-bin/ASD/energy1.pl
NIST Atomic Spectra Database Levels Data
Example of how to reference these results:
Ralchenko, Yu., Kramida, A.E., Reader, J., and NIST ASD Team (2008). NIST Atomic
Spectra Database (version 3.1.5), [Online]. Available: http://physics.nist.gov/asd3 [2009,
November 26]. National Institute of Standards and Technology, Gaithersburg, MD.
Query the NIST Atomic Energy Levels Bibliographic Database for Ar XVIII
Ar XVIII 26 Levels Found
Configuration Term
J Level (eV)
1s
2
S
1
/
2
0.0
2p
2
P°
1
/
2
[3 318.1761]
3
/
2
[3 322.9917]
2
s
2
S
1
/
2
[
3
318.3374
]
3p
2
P°
1
/
2
[3 934.2931]
3
/
2
[3 935.7204]
3s
2
S
1
/
2
[3 934.3415]
3d
2
D
3
/
2
[3 935.7179]
5
/
2
[
3
936.1899
]
4p
2
P°
1
/
2
[4 149.7378]
3
/
2
[4 150.3398]
4s
2
S
1
/
2
[4 149.7583]
4d
2
D
3
/
2
[4 150.3387]
5
/
2
[
4
150.5379
]
4f
2
F°
5
/
2
[4 150.5375]
7
/
2
[4 150.6368]
5p
2
P°
1
/
2
[4 249.3741]
3
/
2
[4 249.6822]
5
s
2
S
1
/
2
[
4
249.3847
]
5d
2
D
3
/
2
[4 249.6817]
5
/
2
[4 249.7837]
5f
2
F°
5
/
2
[4 249.7835]
7
/
2
[4 249.8344]
5
g
2
G
7
/
2
[
4
249.8344
]
9
/
2
[4 249.8649]
Limit --- 4 426.2226

Master Phys. de Rayonnement ; Spectroscopie et profils de raies spectrales ;
Prof. F. Khelfaoui ; Université de Ouargla (Décembre 2012) Page 3
IV. Somme et composition des moments cinétiques
V. Règles de Hund et classement des niveaux d’énergie
1) Application des règles du Hund.
2) Diagrammes des niveaux d’énergie et transitions radiatives de :
- Hydrogène, ions Hydrogénoïdes et métaux alcalins ;
- Hélium et ions Héliumoïdes ;
- Atomes multiélectroniques.
VI. Effet Zeeman et effet Stark
1) Effet Zeeman
L'influence d'un champ magnétique sur les niveaux d'énergie d'un émetteur a été
étudié par Zeeman en 1896, il a observé que chaque raie émise par un ion ou un atome soumis
à un champ magnétique se décompose en un certains nombre de raies équidistantes, séparées
par des intervalles proportionnels au champ magnétique. Cette décomposition des raies
provient en fait de la décomposition des niveaux qui seront séparées par l'intervalle g μB B.
La correction dans l’énergie due au champ B est :
( 2 )
B
mag
H L S B
µ
= +
r
r r
h
mag B J
E g Bm
µ
= avec :
, 1, 2,....,
J
m J J J J
= − − + − + +
Où B : est le champ magnétique homogène ; μB : est le magnéton de Bohr et g est le
facteur de Landé défini par : ( 2 )
L S gJ
+ =
r
r r
On donne : B
2 2
e
eh
m
µ
π
=
3 ( 1) ( 1)
2 2 ( 1)
S S L L
gJ J
+ − +
= + +
e: la charge de l'électron ; h: la constante de Planck ; me: la masse de l'électron.
Le champ magnétique externe B cause une levée totale de la dégénérescence des
niveaux (suivant les valeurs de m ou mj). Le phénomène est appelé Effet Zeeman pour les
champs magnétiques faibles et Effet Paschen-Back pour les champs magnétiques forts.
On note aussi les transitions radiatives (Effets Zeeman normal et anormal)
2) Effet Stark
Un champ électrique externe permet une levée partielle de la dégénérescence des
niveaux (suivant les valeurs de m ou mj). Le phénomène est appelé Effet Stark.
.
Stark
H d E
= −
r
r
( )
d e r
= −
r
r
et
z z
E E e
=
r
r
soit Stark z
H eE z eEz
= =

Master Phys. de Rayonnement ; Spectroscopie et profils de raies spectrales ;
Prof. F. Khelfaoui ; Université de Ouargla (Décembre 2012) Page 4
E<105V/m sinon la correction Stark serait du même ordre de grandeur que celle de la
structure fine.
Pour plusieurs électrons (N), le moment dipolaire électrique est :
1
N
i
i
D er
=
=
∑
r
r
et l’hamiltonien devient :
Stark z
H ED
= −
Au 1er ordre de la théorie de perturbation :
0
Stark J z J
E E LSJM D LSJM
γ γ
∆ = − =
Au 2ème ordre de la théorie de perturbation :
'
2
'
2
' ' ' ' ' ' ' ' '
' ' ' ' '
J
J z J
Stark
L S J M LSJ L S J
LSJM D L S J M
E E E E
γγ γ
γ γ
∆ = −
∑
La somme est sur les états
'
' ' ' ' '
J
L S J M
γ
qui ont une parité opposée de celle de
J
LSJM
γ
.
Le déplacement est quadratique (ou effet Stark quadratique).
Dz est diagonal pour MJ et pour S, alors MJ ‘ = MJ et S’=S.
Les règles de sélection sont :
0, 1
J
∆ = ±
En utilisant les coefficients de Clebsh-Gordan 1 0 '
J J
J M J M
on démontre que :
2 2
( )
Stark J
E E A BM
∆ = +
On note une levée partielle de dégénérescence :
J J
M M
= ±
En plus des déplacements des niveaux, le champ électrique a un effet sur le
mélange des états de parité opposé. Une fonction d’onde 2PJ perturbée contient de petit
mélange de la fonction d’onde 2DJ. Par conséquence en présence d’un champ électrique on
observe des séries de raies interdites :
2 2
'
n S n D
→ et
2 2
'
n S n S
→
Les règles de sélection en générale sont :
0, 1;(int :0 0)
0
1
0, 1;(int :0 0)
i
L erdite
S
l
J erdite
∆ = ± →
∆ =
∆ = ±
∆ = ± →
Remarque : Dans le cas où le champ électrique est fort (par rapport à la structure fine) le
traitement doit être appliqué sur les fonctions d’onde
nlm
Ψ = Ψ
. Pour l’hydrogène par
exemple, nous avons un déplacement linéaire des états du niveau n=2 et un déplacement
quadratique de l’état 1s.

Master Phys. de Rayonnement ; Spectroscopie et profils de raies spectrales ;
Prof. F. Khelfaoui ; Université de Ouargla (Décembre 2012) Page 5
VII. Transitions radiatives : Règles de sélection pour les approximations
dipolaire électrique, dipolaire magnétique et quadripolaire électrique
A noter que :
5
1
1
10
M
E
AA
−
et
6
2
1
10
E
E
AA
−
VIII. Transitions radiatives spontanées et stimulées du rayonnement
1) Introduction :
Les transitions radiatives entre les niveaux d’énergie atomiques se font de deux
manières :
a) Transitions stimulées à cause de l’existence du champ de rayonnement externe
agissant sur l’atome ;
b) Transitions spontanées causées par des propriétés internes à l’atome et indépendants
du champ de rayonnement.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%