Avastin - Swissmedic

Roche Pharma (Suisse) SA Schönmattstrasse 2
CH-4153 Reinach
www.roche-pharma.ch
Tél. +41 (0) 61 715 41 11
Fax +41 (0) 61 715 41 12
1/3
COMMUNICATION IMPORTANTE
Adresse
Reinach,
le 2
4
février
201
2
Avastin
®
(bé
vacizumab),
solution
à diluer
pour perfusion
Avastin dans le cancer du sein métastatique: révocation de l’association Avastin et
docétaxel
Docteur,
D’entente avec Swissmedic, Roche Pharma (Suisse) SA désire vous informer au sujet d’une
modification importante apportée à l’AMM d’Avastin
®
(bévacizumab) dans le traitement de
première ligne des patients souffrant d’un cancer du sein métastatique HER-2 négatif.
Avastin est un anticorps monoclonal recombinant humanisé qui est autorisé pour le traitement par
voie intraveineuse de certains types de cancers et qui est dirigé contre le facteur de croissance de
l’endothélium vasculaire (VEGF).
Au cours d’une procédure de contrôle indépendante, Swissmedic a réévalué les données étayant
l’AMM accordée à Avastin dans le cancer du sein HER-2 négatif et a annoncé le 15.2.2012 la
décision suivante relative à l’AMM d’Avastin dans le cancer du sein métastatique:
• L’indication du traitement de première ligne par Avastin en association avec le docétaxel
du cancer du sein métastatique est révoquée sur la base de nouvelles données qui montrent
un rapport bénéfice/risque défavorable.
• Le rapport bénéfice/risque du traitement par Avastin en association avec le paclitaxel reste
inchangé et reste considéré comme favorable.
• La décision de Swissmedic n’a aucune influence sur l’autorisation d’Avastin dans d’autres

2/3
indications.
L’association d’Avastin avec le docétaxel pour le traitement de première ligne du cancer du sein
métastatique a été autorisée en octobre 2009 sur la base de données qui avaient montré un avantage
faible mais significatif en termes de survie sans progression (étude AVADO).
La décision de Swissmedic de retirer l’AMM de l’association avec le docétaxel repose sur des
données issues de la nouvelle étude portant sur cette association (étude RIBBON-1). Ces données
ont soulevé des questions concernant l’effet sur la survie globale. Plus précisément, un effet négatif
sur la survie globale n’a plus pu être exclu avec certitude pour l’association Avastin et docétaxel. En
outre, l’effet de cette association sur la survie sans progression (survie sans aggravation du tableau
clinique) doit également être remis en cause. Deux études (AVADO et RIBBON-1) viennent de
révéler que cet effet est plus faible que l’effet observé lors de l’étude d’enregistrement E2100
concernant l’association paclitaxel et Avastin.
Au vu de l’incertitude concernant la survie globale, du faible avantage pour la survie sans
progression et de la toxicité plus élevée du traitement combiné, le rapport bénéfice/risque de
l’association bévacizumab et docétaxel est réévalué de façon défavorable.
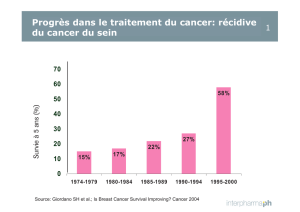
• L’étude E2100 a évalué l’efficacité et la sécurité d’Avastin en association avec le paclitaxel
par rapport à une monothérapie par le paclitaxel dans le bras témoin:
Durée médiane de la survie sans progression: 5,8 mois dans le bras témoin vs 11,4 mois dans
le bras sous Avastin (HR 0,42; p<0,0001).
Durée médiane de la survie globale: 24,8 mois dans le bras témoin vs 26,5 mois dans le bras
sous Avastin (HR 0,87; p<0,14).
• L’étude BO17708 (AVADO) a évalué l’efficacité et la sécurité d’Avastin à la posologie de 7,5
mg/kg de poids corporel (bras Bv7,5) et de 15 mg/kg de poids corporel (bras Bv15), chaque
fois en association avec le docétaxel et en comparaison au docétaxel plus placebo:
Durée médiane de la survie sans progression: 8,2 mois dans le bras témoin vs 9,0 mois dans le
bras Bv7,5 (HR 0,86; p=0.1163) vs 10,1 mois dans le bras Bv15 (HR 0,77; p=0,0061).
Durée médiane de la survie globale: 28,1 mois dans le bras témoin vs 29,6 mois dans le bras
Bv7,5 (HR 1,01; p=0,95) vs 31,7 mois dans le bras Bv15 (HR 0,98; p=0,86).
• L’étude AVF3694g (RIBBON-1) a évalué l’efficacité et la sécurité d’Avastin en association
avec différentes chimiothérapies. Dans le sous-groupe Avastin plus docétaxel, en
comparaison au docétaxel (n=78):
Durée médiane de la survie sans progression: 8,4 mois dans le bras témoin vs 9,2 mois dans le
bras avec Avastin (HR 0,78; p=0,17).
Durée médiane de la survie globale: not reached dans le bras témoin vs 27,0 mois dans le bras
avec Avastin (HR 1,45; p=0,14).

3/3
En raison de cette modification apportée à l’AMM d’Avastin dans le cancer du sein métastatique
HER-2 négatif, l’information professionnelle concernant Avastin est en cours de révision en accord
avec Swissmedic. La version révisée sera publiée sur FastOnline (www.documed.ch).
Annonce d’effets indésirables
Nous vous prions de faire parvenir les annonces d’effets indésirables à l’aide du formulaire
d’annonce au Centre régional de pharmacovigilance responsable. Ce formulaire est disponible sur le
site de Swissmedic (www.swissmedic.ch → Accès direct à → Annonce d'effets indésirables →
Pharmacovigilance) et en annexe du Compendium suisse des médicaments ou peut être
directement commandé chez Swissmedic (tél. 031 322 02 23).
Si vous avez des questions ou si vous avez besoin d’informations supplémentaires concernant
l’utilisation d’Avastin dans le cancer du sein métastatique, veuillez vous adresser au Dr Sabine Nick,
Group Medical Manager Oncology (tél. 061 715 43 73).
Avec nos salutations distinguées,
Roche Pharma (Suisse) SA
Dr
mé
d.
Titus Gylvin
Director Medical Affairs
Dr
Sven Inäbnit
Director Regulatory Affairs
1
/
3
100%