Quelques aspects de l`interaction des hormones stéroïdes

Quelques
aspects
de
l’interaction
des
hormones
stéroïdes
avec
leurs
cellules
cibles
E.-E.
BAULIEU
Inserm
U
33,
Faculté
de
Médecine,
Université
Paris-Sud,
Lab.
Hormones,
94270
Bicêtre,
France.
Summary.
Some
aspects
of
steroid
hormone-target
cell
interaction.
Specific
steroid
hormone
binding
proteins
in
target
cells
are «
receptors>>.
Five
steroid
receptors
have
been
described
for
estrogens,
androgens,
progesterone,
glucocor-
ticosteroids
and
mineralocorticosteroids,
respectively.
Their
affinity
for
the
natural
ligand
corresponds
to
KD
approx.
0.1
nM.
The
purified
estradiol
receptor
of
the
calf
uterus
appears
to
be
a
single-chain
protein
with
a
MW
of
approx.
70 000.
Antibodies
against
this
receptor
cross-react
with
other
mammalian
and
avian
estradiol
receptors.
Steroid
hormone-receptor
complexes
act
in
the
cell
nucleus.
The
mechanism
changing
gene
expression
is
still
unknown.
In
the
chick
oviduct
system,
non-estrogenic
antiestro-
genic
tamoxifen
forms
nuclear
complexes
with
the
receptor,
suggesting
that
receptor
translocation
from
the
cytoplasm
to
the
nucleus
is
not
necessarily
an
indication
of
hor-
mone
agonistic
activity,
and
that
the «
acceptor »
concept
may
have
to
be
redefined.
Steroid
hormone
levels
vary
in
target
cells.
Both
homologous
and
heterologous
hor-
mones
may
control the
concentration
of
a
given
steroid
receptor,
either
positively
or
negatively.
Receptor
variations
during
the
estrous
and
menstrual
cycles
appear
to
be
correlated
with
changes
of
steroid
hormone
levels
in
the
plasma.
Steroid
receptor
concen-
trations
in
target
cells
also
follow
ontogenetic
patterns
reflecting
genetic
variations
and
pathological
changes,
i.e.
in
cancer
cells.
The
receptor
must
be
present
for
steroid
hor-
mone
response,
and
it
appears
that
its
concentration
is
directly
implicated
in
the
extent
of
the
effect
obtained.
Thus,
the
level
of
nuclear
hormone
receptor
complexes
and
its
per-
sistence
are
important
factors.
A
physiological
pharmacology
of
natural
and
synthetic
hormones
and
antihormones
can
be
based
on
binding
properties,
plurality
and
changes
in
receptor
concentration.
Bin-
ding
parameters
per se
do
not
indicate
whether
a
binding
steroid
or
analog
will
be
agonist
or
antagonist.
Besides
binding
affinity,
the
metabolism
of
a
given
hormone,
and
therefore
its
availability
at
the
target
cell
level,
are
important
criteria
in
determining
the
response
level.
Binding
to
steroid
binding
plasma
proteins
must
also
be
considered.
Besides
the
already
«
classical
»
steroid-intracellular
receptor
system
acting
at
the
nuclear
level,
work
in
Xenopus
leavis
oocytes
has
suggested
that
steroids
may
act
at
the
surface
membrane
level,
reinitiating
meiosis.
The
significance
of
this
finding
is
discussed
with
reference
to
the
possible
effects
of
steroid
hormones
on
somatic
cells
at
the
membrane
level.
It
remains
to
be
established
if
a
steroid
hormone
can
have
several
molecular
action
mechanisms
in
a
single
target
cell.

Ce
texte
résume
les
observations
qui
ont
conduit
à
la
découverte
des
récepteurs
des
hormones
stéroïdes
et
il
indique
à
quel
niveau
de
compréhension
on
est
arrivé
(1,
11).
Nous
détaillons
ensuite
les
principales
notions
physiologiques
et
pharmacologiques
permettant
d’étudier
la «
réceptivité »
hormonale.
Il
s’agit
en
particulier
de
la
régula-
tion
de
la
concentration
des
récepteurs
(III),
de
la
pluralité
des
liaisons
hormonales
et
de
la
multiplicité
cellulaire
des
récepteurs
(IV).
Puis
nous
résumons
des
recherches
récentes
sur
la
méiose
de
l’ovocyte
de
Xenopus
laevis,
qui
permettent
d’étudier
l’effet
de
la
progestérone
dans
un
cas
qui,
contrairement
au
système
des
récepteurs
intra-
cellulaires
classiques,
implique
une
interaction
du
stéroïde
au
niveau
de
la
surface
de
la
cellule ;
la
portée
plus
générale
de
cette
observation
est
discutée
ensuite
(V).
1.
-
Les
«
récepteurs »
sont
des
protéines
liant
spécifiquement
les
hormones
stéroïdes
dans
leurs
cellules
cibles.
C’est
le
récepteur
de
l’oestradiol
qui
a
inauguré
le
domaine
des
récepteurs
des
hor-
mones
stéroïdes,
et
de
fait
il
a
été
le
premier
de
tous
les
récepteurs
à
être
caractérisé,
bien
avant
ceux
des
autres
hormones
(en
particulier
polypeptidiques)
et
des
neuro-
médiateurs.
Le
mot
et
le
concept
du
récepteur
avaient
été
initialement
définis
et
utilisés
par
les
pharmacologistes,
et malgré
la
préscience
de
Langley
il
y
a
100
ans
et
l’orien-
tation
chimique
d’Ehrlich
au
début
du
siècle,
ils
en
étaient
restés
à
des
études
purement
phénoménologiques.
En
fait,
ce
sont
des
endocrinologistes-biochimistes
qui
ont
pour
la
première
fois
mis
en
évidence
des
interactions
physico-chimiques
signifiantes,
et
très
précisément
en
utilisant
l’oestradiol
tritié
de
haute
activité
spécifique.
L’œstrogène
naturel,
l’aestradiol,
est
spécifiquement
concentré
et
retenu
dans
ses
organes
cibles
(1).
Cette
observation
fondamentale
a
pu
être
expliquée
en
termes
bio-
chimiques
par
les
propriétés
intrinsèques
d’une
protéine
intracellulaire
solubilisée
faci-
lement
à
partir
des
cellules
cibles.
En
effet,
les
études
de
liaison
in
vitro
démontrèrent
une
spécificité
stricte
de
signification
biologique
évidente
(2,
3).
Deux
techniques
furent
utilisées :
1)
L’ultracentrifugation
en
gradient
de
saccharose
(ou
de
glycérol)
qui
permit,
après
incubation
in
vitro
avec
l’hormone
radioactive,
d’isoler
des
complexes
radioactifs«
8
S »
en
milieu
de
faible
force
ionique
(4) ;
2)
L’utilisation
des
adsorbants
et
avant
tout
le
charbon
actif
(mélange
charbon-dextran)
qui,
en
rationalisant
les
résultats
selon
le
principe
de
la
dissociation
différentielle
(5),
permirent
des
études
quantitatives
(2).
Les
récepteurs
des
hormones
stéroïdes
ont
une
affinité
très
élevée
pour
les
composés
biologiquement
actifs,
les
valeurs
de
K
De
q
étant
de
l’ordre
de
0,1
nM,
ce
qui
est
parfaitement
adapté
aux
concentrations
circulantes
des
hormones
correspondantes.
Les
vitesses
de
dissociation
très
lentes
des
complexes
hormone-
récepteurs
(6,
7)
sont
compatibles
avec
la
rétention
prolongée
du
stéroïde
hormonal
observée
par
les
expériences
in
vivo
(1).
Sur
la
base
de
cette
propriété,
et
bien
que
seuls
des
résultats
indirects
indiquent
actuellement
que
ces
protéines
liantes
intracellulaires
sont
véritablement
impliquées
dans
la
médiation
de
l’activité
hormonale
(8),
elles
furent
appelées«
récepteurs ».
En
tout
cas
ces
protéines
sont
certainement
différentes
d’autres
protéines
liant
les
stéroïdes
que
l’on
trouve
dans
le
plasma,
dans
les
testicules,
dans
le
foie,
dans
la
prostate,
etc...,
dont
les
propriétés
de
liaison
ne
rendent
pas
compte
de
l’activité
biologique
des
ligands
(8).
Par
exemple,
la
protéine
plasmatique
(Sex
Steroid
Binding
Plasma
Protein)

(SBP)
(9)
qui
lie
l’cestradiol
avec
une
affinité
élevée,
lie
également
la
testostérone,
et
même
plus
étroitement,
ce
qui
contraste
avec
le
récepteur
de
l’cestradiol
dont
l’affinité
pour
les
androgènes
est
très
faible.
Réciproquement,
le
diéthylstilboestrol
(DES),
un
aestrogène
de
synthèse
actif
mais
non
stéroïde,
se
lie
au
récepteur
de
l’oestradiol
et
à
peine
à
la
SBP
ou
à
l’«-foetoprotéine
chez
le
rat
(«-FP)
(10,
10
bis).
Il
s’agit
bien
de
protéines
distinctes,
et
les
observations
récentes
avec
des
anticorps
anti-récepteur
de
l’oestradiol
(11),
anti-«-foetoprotéine
(12)
et
anti-SBP
(13)
confirment
la
singularité
du
récepteur
de
l’aestradiol.
Elles
montrent
de
plus
que
le
récepteur
de
l’aestradiol
des
différents
organes
de
différents
mammifères
ont
des
déterminants
antigéniques
com-
muns
avec
le
récepteur
de
l’utérus
de
veau
(14). Très
récemment (15)
nous avons même
observé
l’interaction
d’anticorps
anti-récepteur
de
l’aestradiol
de
l’utérus
de
veau
avec
le
récepteur
nucléaire
de
l’cestradiol
de
l’oviducte
de
poule :
comme
si
le
récepteur
de
l’oestradiol
était
remarquablement
préservé
au
cours
de
l’évolution,
comme
par
exemple
une
enzyme
importante,
la
RNA-polymérase
B.
Un
récepteur
a
été
décrit
pour
chacune
des
5
hormones
stéroïdes
physiologique
ment
bien
définie.
En
plus
du
récepteur
de
l’aestradiol,
ce
sont
le
récepteur
des
andro-
gènes,
d’abord
décrit
dans
la
prostate
ventrale
de
rat
(16-18) ;
le
récepteur
de
la
proges-
térone,
d’abord
observé
dans
l’utérus
de
cobaye
(19)
et
dans
l’oviducte
aviaire
(20) ;
le
récepteur
des
glucocorticostéroïdes,
découvert
dans
les
cellules
de
thymus
(21)
et
le
récepteur
des
minéralocorticostéroïdes,
détecté
dans
la
vessie
de
crapaud
(22)
et
étudié
dans
le
rein
de
rat
(23).
Dans
l’ensemble
les
affinités
correspondent
dans
chaque
cas
aux
activités
biologiques
de
la
plupart
des
agonistes.
La
concentration
des
récepteurs
dans
les
cellules-cibles
est
de
l’ordre
de
10000
par
cellule,
avec
des
valeurs
variant
entre
10
3
et
10
5.
Certaines
propriétés,
en
particulier
de
liaison,
indiquent
une
grande
similitude
entre
les
récepteurs
des
différents
organes
et
des
diverses
espèces
animales,
encore
que,
contrairement
au
cas
des
récepteurs
de
l’oestradiol,
les
récepteurs
de
la
progestérone
semblent
différer
chez
les
mammifères
et
les
aviaires.
Avec
chaque
hormone
naturelle,
les
expériences
de
liaison
ont
essentiellement
indiqué
une
seule
catégorie
de
site
d’affinité
élevée
(KDe
q -
0,1
nM) ―
et
aucun
élé-
ment
n’a
démontré
un
effet
coopératif
au
niveau
de
la
liaison.
De
plus,
jusqu’à
présent,
les
travaux
de
purification,
les
recherches
immunologiques
ou
les
études
de
liaison
n’ont
pas
indiqué
que
les
récepteurs
soient
hétérogènes.
En
fait,
les
fréquentes
réfé-
rences
à
l’«
hétérogénéité »
des
récepteurs
semblent
correspondre
surtout
à
des
diffé-
rences
de
taille
ou
d’extractibilité
attribuables
à
des
circonstances
expérimentales
particulières
(agrégation,
protéolyse).
La
signification
du
récepteur
nucléaire
«inso-
luble »
(24),
et
la
raison
pour
laquelle
une
fraction
des
sites
de
la
progestérone
n’est
apparemment
pas
transférée
dans
le
noyau
(25)
restent
assez
obscures.
Il
est
cependant
possible
que
les
récepteurs
eux-mêmes
pourraient
interagir
avec
plusieurs
structures
différentes
dans
la
même
cellule.
De
plus
dans
des
cellules
de
différenciation
distincte,
le
récepteur
se
lierait
sélectivement
avec
des
« accepteurs »
et/ou
des
« effecteurs »
différents,
ce
qui
serait
une
base
logique
pour
comprendre
que
la
même
hormone
puisse
donner
lieu
à
différents
effets,
bien
qu’interagissant
avec
le
même
récepteur
dans
tous
les
cas.
La
structure
des
récepteurs
des
hormones
stéroïdes
n’est
pas
connue,
en
dépit
des
progrès
importants
des
techniques
de
chromatographie
d’affinité
(26-29).
Nous
savons
qu’il
s’agit
de
protéines,
de
poids
moléculaire -
70000
dans
le
cas
du
récepteur
de

l’oestradiol
d’utérus
de
veau,
si
l’on
considère
une
unité
de
liaison.
Une
protéolyse
par-
tielle
peut
dans
tous
les
cas
découper
une
portion
de
la
protéine
sans
pour
autant
chan-
ger
les
caractéristiques
de
liaison
hormonale
(30-32).
Les
anticorps
produits
à
partirdu
récepteur
extrait
du
cytosol
(11)
ou
des
noyaux
(14)
sont
très
semblables.
La
purifica-
tion
à
grande
échelle
(des
mg)
des
récepteurs
est
une
des
exigences
de
la
recherche
dans
ce
domaine.
Il.
-
Les
complexes
récepteur-hormone
stéroïde
agissent
dans
le
noyau
des
cellules
cibles.
Les
complexes
des
hormones
stéroïdes
et
de
leurs
récepteurs
s’accumulent
dans
le
noyau
des
cellules
cibles
où,
en
toute
probabilité,
ils
déclenchent
les
principales
réponses
en
affectant
la
transcription
des
gènes.
On
sait
depuis
longtemps
que
la
plupart
des
réponses
aux
hormones
stéroïdes
impliquent
des
changements
de
la
synthèse
des
protéines
et
des acides
ribonucléiques
(33).
Récemment,
l’accumulation
de
m-RNA(s)
spécifique(s)
a
été
démontrée
dans
les
cas
où
la
synthèse
de
la
(ou
des)
protéine(s)
correspondante(s)
était
augmentée
(34,
35).
L’implication
des
récepteurs
dans
ces
effets
découle
de
plusieurs
séries
d’observations.
En
premier
lieu,
dans
de
nombreux
systèmes,
le
récepteur
est
principalement
cytoplasmique
en
l’absence
d’hormone
et
il
transfère
dans
le
noyau
avec
le
stéroïde
(36,
37).
Ce
changement
de
la
distribution
subcellulaire
des
récepteurs
semble
refléter
ce
que
l’on
a
appelé
l’«
activation »
du
récepteur,
qui
peut
être
définie
expérimentalement
comme
un
accroissement,
après
liaison
du
stéroïde,
de
l’affinité
du
récepteur
pour
des
polyanions
dont
le
DNA
(38,
39)
*.
Les
études
autoradiographiques
ont
montré
que
les
stéroïdes
se
localisent
préférentiellement
au
niveau
des
noyaux
dans
les
cellules
cibles
(40),
et
très
récemment,
on
a
observé
une
association
sélective
du
récepteur
(de
l’oestradiol)
avec
des
éléments
chromatiniens
solubilisés
de
l’oviducte
de
poule
(41, 42).
Cependant
on
verra
plus
loin
que
le
transfert
nucléaire
du
récepteur
après
liaison
d’un
ligand
ne
mène
pas
nécessairement
à
la
réponse
hormonale.
Ainsi
insistons-nous
sur
le
fait
qu’il
faut
distinguer
entre
les
sites
accepteurs
et
effecteurs
du
récepteur
comme
il
est
indiqué
sur
la
figure
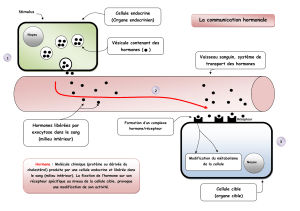
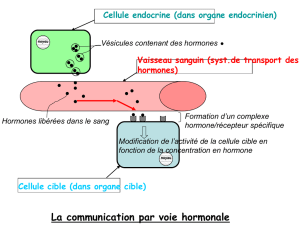
1.
De
plus
le
transfert
du
récepteur
n’est
probable-
ment
pas
toujours
nécessaire
pour
la
réponse
hormonale,
en
particulier
quand
le
récepteur
est
déjà
localisé
dans
le
noyau
en
l’absence
d’hormones
(43,
44)
ou
quand
il
a
été
transloqué
préalablement
par
une
anti-hormone
(voir
chap.
IV).
Nous
pensons
donc
que
la
présence
dans
le
noyau
de
complexes
hormone-récepteur
actifs
déclenche
des
réponses
hormonales
au
niveau
de
sites
e ffecteurs.
Aussi
insistons-nous
sur
la
struc-
ture
du
ligand
favorisant
la
conformation
active
du
récepteur,
plus
que
sur
la
localisa-
tion
initiale
du
récepteur
(libre)
dans
le
cytoplasme
ou
dans
le
noyau.
Cette
proposition
a
pour
conséquence
de
diminuer
l’importance
de
la
redistribution
du
récepteur,
bien
que
dans de
nombreux
systèmes
celle-ci
soit
une
conséquence
(utile)
de
la
formation
des
complexes
hormone-récepteur
actifs.
*
Le
destin
ultérieur
des
complexes
hormone-récepteur
dans
les
cellules
après
l’étape
nucléaire
et
le
déclenchement
de
la
réponse,
n’est
pas
connue.
«
Désactivation
» ou
«
altération
par
protéo-
lyse
» sont
parmi
les
possibilités
qui
ont
été
proposées.

D’autre
part,
l’incorporation
accrue
de
précurseurs
radioactifs
dans
l’ARN
a
été
observée
après
exposition
des
noyaux
de
cellules cibles
à
des
extraits
cytoplasmiques
contenant
des
complexes
hormone-récepteur
(45).
Cette
constatation
a
permis
de
sug-
gérer
la
participation
directe
du
récepteur
à
l’effet,
puisque
l’hormone
à
elle
seule
n’est
pas
active
sur
le
noyau
ne
contenant
pas
de
récepteur.
Ces
observations,
comme
les
connaissances
actuelles
sur
les
processus
de
transcription
sur
les
cellules
eucaryotes,
restent très
primitives.
Jusqu’à
présent
il
n’y
a
pas
de
démonstration
décisive
que
l’addi-
tion
d’un
complexe
hormone-récepteur
à
une
préparation
chromatinienne
en
modifie
la
transcription,
en
particulier
en
ce
qui
concerne
la
synthèse
d’un
ARN
messager
spé-
cifique
(46).
En
fait
toutes
les
réponses
provoquées
par
les
hormones
stéroïdes
sont
mal
Un
mécanisme
de
transduction
ou
de
couplage
prend
place
entre
r
et
le
(s)
site
(s)
a
et/ou
e.
La
réponse
prend
place
au
niveau
d’une
structure
effectrice
E
de
la
machine
cellulaire.
Le
récepteur
a
un
site
e
(pour
«
effecteur
»,
«
exécutif
»)
qui
interagit
avec
E,
soit
qu’il
s’agisse
de
catalyser
l’ac-
tion
chimique
(R
est
alors
un
enzyme
allostérique),
ou
simplement
de
liaison
à
E
(et
dans
ce
cas
les
sites
e
et
a
peuvent
être
confondus).
De
toute
façon,
il
existe
une
spécificité
necessaire
pour
expliquer
que
les
effets
différents
puissent
être
déclenchés
par
différents
récepteurs
d’hormones
stéroïdes
dans
la
même
cellule.
A
est
une
autre
partie
de
la
machine
cellulaire
appelée
Accepteur
avec
lequel
le
site
a
du
récepteur
peut
interagir.
A
correspond
opérationnellement
à
l’endroit
auquel
se
lie
le
complexe
hormone-récepteur,
avec
une
affinité
inconnue
et
des
sites
qui
sont
peut-être
en
nombre
très
élevé
et
ne
sont
pas
nécessairement
tous
identiques
(114).
Il
est
possible
mais
pas
démontré,
qu’un
petit
nombre
de
sites
de
haute
affinité
soit
caché
par
un
nombre
plus
grand
de
sites
d’affinité
plus
faible
(50).
On
sait
que
les
stéroïdes
peuvent
provoquer
la
synthèse
accrue
de
nombreuses
protéines
(comme
dans
le
cas
de
la
croissance
cellulaire
provoquée
par
les
hormones
sexuelles)
ou
seulement
de
quelques-unes
(comme
dans
le
cas
de
l’aldostérone
agis-
sant
sur
le
transport
du
sodium) :
aucune
différence
n’a
été
observée
au
niveau
du
système
des
récepteurs.
En
d’autres
termes,
on
ne
sait
pas
encore
quelle
est
la
relation
reliant
l’état
du
récep-
teur
dans
le
noyau
et
le
type
de
la
réponse
hormonale.
A
et
E
peuvent
ou non
être
une
même
structure,
partiellement
ou
totalement, et
la
même
chose
est
possible
pour
a
ou
e.
L’effet
provoqué
par
la
liaison
d’une
anti-hormone
au
site
r
peut
provoquer
des
changements
de
confor-
mation
ou
stabiliser
une
autre
conformation
du
récepteur,
modifiant
par
conséquent
le
fonction-
nement
des
sites
a
et/ou
e,
et
abolissant
ainsi
l’effet
hormonal.
Nous
n’avons
pas
indiqué
sur
cette
figure
la
possibilité
qu’il
existe
un
autre
site
sur
le
récepteur
pour
des
ligands
antagonistes
(116,
95),
ni
des
sites
qui
pourraient
être
impliqués
dans
l’inactivation
des
récepteurs
(comme
on
l’a
démontré
avec
la
progestérone
(5).
Les
faits
obtenus
par
les
chercheurs
de
divers
laboratoires
(31,
34,
57, 117-120)
sont
compatibles
dans
l’ensemble
avec
le
schéma
présenté.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%