specialities

specialities
Les photocatalyseurs à base de dioxyde de ti-
tane dansla lumière visible et leurs possibilités
d’emploi – Une introduction par Dr. Stephan Blöß
Le dioxyde de titane est un absorbant d’UV connu,
mais il peut aussi être utilisé pour déclencher des
réactions chimiques par le rayonnement ultraviolet.
Le dopage en carbone de ce semi-conducteur a
pour effet d’engendrer des niveaux d’énergie dans
l’intervalle entre les bandes d’énergie. Il devient ainsi
possible d’activer le catalyseur non seulement par le
rayonnement ultraviolet mais aussi par la lumière vi-
sible. Dans un processus de cycle photocatalytique,
des radicaux inorganiques sont constitués à partir
de l’eau et de l’oxygène de l’atmosphère ambiante.
Ces radicaux oxydent à leur tour des composés or-
ganiques, par exemple des carbures d’hydrogène
aromatiques et aliphatiques, ou des molécules inor-
ganiques, par exemple des oxydes azotiques et du
monoxyde de carbone, en dioxyde de carbone, nitra-
tes et eau comme produits naux que la végétation
peut absorber facilement. On trouve des applications
possibles par exemple dans les surfaces autonet-
toyantes ainsi que pour la réduction de la pollution
de l’air et de l’eau, où leur superhydrophilie et leur
grade surface spécique peuvent être mises à prot.
1. Introduction
Le dioxyde de titane (TiO2) est employé comme pig-
ment blanc pur depuis près d’un siècle. En raison de
son indice de réfraction élevé, le TiO2 peut pigmenter
de nombreuses substances pour créer des systèmes
de matières dotés d’un bon pouvoir couvrant [1] Les
propriétés semi-conductrices connues du TiO2, avec
un intervalle de bande de 3,2 eV pour la modication
anatase et de 3 eV pour la modication rutile (ce qui
correspond à une longueur d’onde limite de respecti-
vement 388 nm et 413 nm) peuvent
être exploitées pour absorber le rayonnement UV.
L’absorption de ce rayonnement « agressif » peut
protéger le sub-strat et empêcher la dégradation de
la matrice polymère. Toute-fois pendant l’absorption
du rayonnement UV, le TiO2 forme malheureusement
sur la surface du pigment des radicaux susceptib-
les de détériorer à leur tour la molécule polymère
de la matrice.[2] Pour empêcher cette réaction, les
pigments de TiO2 sont généralement enrobés avec
divers oxydes métalliques incolores tels que l’oxyde
d’aluminium, l’oxyde de silice ou l’oxyde de zircon.
Depuis la n des années 1970, des scientiques in-
ves-tiguent le côté utile des propriétés semi-conduc-
trices du TiO2. Des études en laboratoire ont révélé
que les radicaux engendrés au cours du processus
photocatalytique peuvent dégrader des polluants tels
que les gaz toxiques ou les odeurs indésirables. [3]
L’intervalle de bande du semi-conducteur TiO2 peut
être rétréci par dopage du dioxyde de titane avec
certains éléments tels que le carbone ou les métaux
transitoires comme le fer. Suivant le type d’agent de
dopage choisi, qu’il soit de nature ionique, cationique
ou du type intermédiaire, des différences peuvent
être observées dans la grandeur de l’intervalle de
bande.[4] La formation de niveaux d’énergie intermé-
diaires entre la bande de valence et la bande de con-
duction ouvre la possibilité d’utiliser non seulement
le rayonnement ultraviolet mais aussi la lumière visi-
ble pour exciter un électron de la bande de valence.
Cet exciton (paire électron-trou) réagit avec des mo-
lécules d’eau et d’oxygène adsorbées en surface
pour donner des radicaux d’hydroxyde et de perhyd-
roxyde. Ces radicaux peuvent à leur tour oxyder des
molécules tant organiques qu’inorganiques. Par con-
séquent, des polluants atmosphériques peuvent être
dégradés en dérivés tolérables par l’environnement
et le niveau de contamination dans l’eau et sur des
surfaces peut être réduit de manière signicative.
Pour être efcace, le photocatalyseur a besoin de
lumière (énergie) et d’air (eau et oxygène) ainsi que
du contact direct avec le polluant (gaz, liquide ou so-
lide). Pour la majorité des applications, on privilégie
KRONOClean - Purication par la lumière

specialities
une xation du photocatalyseur sur la surface d‘une
matrice ou son intégration dans une structure poreu-
se qui laisse passer la lumière visible. L‘efcience de
tels photocatalyseurs est évaluée par examen des
taux de réduction de substances de test telles que le
monoxyde d‘azote ou l’acétaldéhyde et comparaison
avec les résultats mesurés avec des photocataly-
seurs conventionnels pour le rayonnement UV.
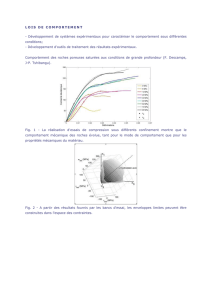
2. Le modèle des bandes
Pour la conductivité électrique, il convient de faire
une distinction entre trois états différents des soli-
des: conducteurs (par exemple métaux tels que l’or
et l’argent), isolants (par exemple polymères tels que
le polypropylène et les polysiloxanes) et semi-con-
ducteurs (par exemple métalloïdes tels que le silici-
um et le germanium) ou semi-isolants (g. 1). Dans
un solide, les orbitales atomiques des éléments sont
reliées en bandes d’énergie. Du fait qu’il existe tou-
jours plus d’orbitales que d’électrons dans un solide,
les électrons occupent le niveau d’énergie inférieur
qui est appelé bande de valence (BV). Le niveau
d’énergie supérieur, qui n’est pas occupé, est appe-
lé bande de conduction (BC). Dans le cas des con-
ducteurs, ces bandes sont très rapprochées (énergie
de l’intervalle de bande Eg < 0,1 eV), si bien que
des électrons peuvent facilement être excités par
l’énergie de la température ambiante et passer de
la BV dans la BC. Il se forme ainsi un courant élec-
trique mesurable, que l’on connaît pour les métaux
(g. 1a). KRONOClean - Purication par la lumière
specialties C’est exactement le contraire pour un
isolant. Les deux bandes sont si éloignées l’une de
l’autre (Eg > 4 eV) que les électrons ne peuvent pas
de températures modérées ou de radiations ayant
une longueur d’onde moyenne pour passer de la BV
dans la BC (g. 1c). Les semi-conducteurs ou se-
mi-isolants se situent entre ces deux extrêmes. Les
bandes sont séparées (0,1 eV < Eg < 4 eV), mais
l’énergie de températures accrues ou du rayonne-
ment normal suft pour exciter un électron (e-) et le
faire sauter de la BV dans la BC (g. 1b). L’électron
« perdu » qui en résulte est appelé trou (h+) et est
mobile dans la BV. Il en est de même de l’électron
qui peut se déplacer dans la BC. Lorsque l’énergie
d’excitation provient de l’irradiation par de la lumi-
ère, on parle d’un solide photo-semi-conducteur. La
longueur d’onde du rayonnement requise pour ex-
citer un électron de la modication anatase du TiO2
doit être inférieure à 388 nm (rayonnement UV(A))
tandis que pour la modication rutile, elle doit se si-
tuer en dessous de 413 nm (lumière violet foncé).
En plus de ces propriétés spéciques d’un soli-
de, il estégalement possible d’engendrer des ni-
veaux d’énergie supplémentaire entre les bandes
d’électrons par dopage avec des éléments sélecti-
onnés. Cet agent de dopage peut remplacer un des
constituants du réseau dans le sousréseau anio-
nique ou cationique (g. 2a et 2b). Il se produit par là
une déformation du réseau, laquelle provoque à son
tour des modications dans la structure des bandes
sous la forme de niveaux d’énergie supplémentaires
(g. 3a) ou une déformation de la bande de valence
elle-même (g. 3b).
Fig. 1 : Modèle de bandes pour un conducteur (a),
un isolant (b) et un semi-conducteur (c)
b
abb
a
Fig. 2 : Dopage en carbone dans le sous-réseau
d’oxygène (a) ou le sous-réseau de titane (b) [9]
BC
BV
a b c

specialities
Selon la théorie de l’excitation des électrons par
rayonnement, il faut moins d’énergie dans ce cas
et lalongueur d’onde dite limite est déplacée vers
des valeurs plus élevées. Par le dopage en carbo-
ne du TiO2 [5-8] dans le sous-réseau cationique, la
longueur d’onde limite de la modication anatase est
déplacée vers 535 nm (lumière verte bleuâtre). Il suf-
t donc d’apporter 2,32 eV dans le système au lieu
de 3,2 eV comme pour l’anatase pure.
3. Photocatalyse
Le terme de photocatalyse est déni en tant
qu’accélération de réactions chimiques par des sub-
stances déterminées (appelées catalyseurs), sans
qu’elles soient consommées pendant la réaction. De
manière générale, la catalyse a lieu par réduction
de l’énergie d’activation, ce qui implique des modi-
cations de la cinétique mais pas de la thermodyna-
mique d’une réaction chimique. L’important pour un
cycle authentique de réaction catalytique est qu’à la
n de la réaction, le catalyseur revienne dans l’état
qu’il présentait au début de la réaction. Une distinc-
tion est faite entre les catalyseurs homogènes et hé-
térogènes. Les catalyseurs homogènes sont dans la
même phase que les partenaires de réaction (par
exemple liquide/solution) tandis que les catalyseurs
hétérogènes se trouvent dans une autre phase (par
exemple solide/ liquide). Des exemples connus de
catalyseurs homogènes sont les catalyseurs Ziegler-
Natta pour la polymérisation et de catalyseurs hété-
rogènes, les catalyseurs au nickel Raney pour les
réactions d’hydrogénation. D’après cette dénition,
le rayonnement ou la forme de particule d’une onde
électromagnétique, un photon, ne peut pas être dési-
gné de catalyseur lors de la photocatalyse. La raison
en est que l’énergie de ce photon est absorbée et uti-
lisée pour la réaction chimique et qu’ensuite un pho-
ton n’est pas émis dans le même état. Il faudrait plus
précisément parler d’une catalyse « photo-induite ».
La photosynthèse des plantes en est un exemple.
Un semi-conducteur peut également servir de pho-
tocatalyseur par l’absorption d’énergie ou le transfert
de cette énergie dans des partenaires chimiques de
réaction. Dans le cas du TiO2, les mécanismes qui
se déroulent alors ont été étudiés de manière appro-
fondie en raison de son large spectre d’applications
comme pigment blanc. Une matrice pigmentée avec
du TiO2 non traité est détruite progressivement par
l’irradiation de lumière solaire. Cet effet est appelé
farinage parce que la poudre blanche (pigment) peut
être détachée de la surface en dégradation de la ma-
trice (g. 4).
Le cycle photocatalytique qui suit cette dégradation
de la matrice polymère commence par l’absorption
de lumière d’une longueur d’onde déterminée. Cette
énergie provoque le passage d’un électron de la BV
dans la BC (g. 5 A). A l’intérieur de ces bandes, la
paire électron-trou formée peut migrer vers la sur-
face du cristal (g. 5 B) où de l’eau adsorbée (H2O)
et de l’oxygène (O2) peuvent être transformés en
r dicaux (g. 5 C). Cette réaction se déroule en deux
étapes :
1. éduction de l’oxygène en radical de perhydroxyde
(HO2 •) par l’électron présent dans la BC et
2. oxydation de l’eau en radical d’hydroxyde (HO•)
par le trou existant dans la BV.
Fig. 3 : Modification de l’intervalle de bande par
des niveaux intermédiaires (a) ou des expansions
de bande (b)
BC
BV

specialities
Ces radicaux, qui se forment aussi dans la nature
par la radiation UV normale d’eau atmosphérique
présente dans la stratosphère, peuvent réagir dans
un processus d’oxydation avec des molécules orga-
niques (p. ex. des carbones aromatiques et alipha-
tiques) ainsi qu’avec des composés inorganiques
pas entièrement oxydés (p. ex. des oxydes azo-
tiques ou du monoxyde de carbone) (g. 5 D). Les
« polluants » inorganiques sont minéralisés jusqu’à
leur degré d’oxydation le plus élevé possible (p. ex.
du monoxyde de carbone (CO) réagit et donne du
dioxyde de carbone (CO2) ou de l’acide carbonique
(H2CO3, g. 5 E).
4. Analyse de l’effet catalytique
Il existe une série de possibilités pour rendre visible
le processus photocatalytique. La mesure de la ré-
sonance de spin électronique (RSE) permet de dé-
celer des électrons individuels à l’aide de molécules
de captage. Les radicaux ne peuvent pas être détec-
tés directement avec ce procédé. On peut observer
l’oxydation de molécules de test par une méthode
plutôt indirecte mais courante. Ces mesures sont
très importantes pour l’identication d’un processus
d’oxydation complet avec tous ses produits interm
diaires. L’acétaldéhyde et l’isopropanol sont souvent
utilisés comme substances de test représentatives
des composés organiques volatils (COV), tandis que
le monoxyde d’azote ou le monoxyde de carbone
font ofce de représentants pour des gaz inorga-
niques toxiques. Pour mesurer des polluants à base
d’eau, on emploie habituellement des substances fa-
cilement décelables telles que les colorants (bleu de
Fig. 4 : PVC pigmenté après irradiation avec de la lumière Xe (à gauche : surface faiblement détruite,
au milieu : surface farineuse, à droite : agrandissement de la vue du milieu)
Fig. 5 : Mécanisme du processus photocatalytique
de TiO2
Fig. 6 : Décomposition de l’acétaldéhyde par le photo-
catalyseur TiO2 actif dans la lumière visible
lumière
Absorption des IR
Absorption des IR
Acétaldéhyde absorption
des IR à 1727 nm
CO2 : absorption des IR
à 2345 nm
Spectroscopie FT-IR
Acétaldéhyde

specialities
méthylène, résazurine ou rhodamine) ou des carbu-
res d’hydrogène chlorés (p. ex. 4-chlorophénol). Une
troisième méthode classique, qui est toutefois très
longue, consiste à exposer le substrat contenant le
photocatalyseur aux agents atmosphériques, soit
par vieillissement accéléré dans des tests QUV ou
WOM, soit par exposition normale à l’extérieur.
Sauf ISO 22197-1(2007) [10] malheureusement, il
n’existe pas encore jusqu’ici de procédés standardi-
sés pour la mesure de la photocatalyse. Ils doivent
toutefois être instaurés dans les années à venir par
des organes de normalisation nationaux et interna-
tionaux.
Des études portant sur la réduction d’acétaldéhyde
avec le photocatalyseur pour la lumière visible (TiO2
dopé de carbone) ont été analysées en détail. Les
spectres infrarouges de l’acétaldéhyde et du di-
oxyde de carbone sont observés durant un laps de
temps (13 heures) pendant lequel le photocatalyseur
est irradié avec de la lumière visible (g. 6). De fa-
çon analogue au processus d’oxydation formel de
l’acétaldéhyde, il se forme deux moles de dioxyde
de carbone par mole d’acétaldéhyde. Ceci apparaît
dans le taux d’augmentation du signal de CO2 deux
fois plus élevé que le taux de diminution du signal
d’aldéhyde.
5. Applications possibles
de photocatalyseurs au TiO2
Sur des surfaces de TiO2 pures, les molécules d’eau
et d’oxygène adsorbées donnent, avec les radicaux
d’oxygène formés, une concentration élevée en
groupes polaires, ce qui aboutit à un effet appelé «
superhydrophilie ». Cela signie que l’angle de con-
tact entre la surface et une goutte d’eau est inférieur
à 5 degrés. De ce fait, l’eau ne reste pas à l’état de
goutte mais se répartit en une mince pellicule.
Un des mécanismes d’autonettoyage des surfaces
se révèle ici dans cet effet anti-buée et est l’exact
contraire de la superhydrophobie des uorosiloxa-
nes et de l’effet dit lotus. Dans ce dernier cas, la
poussière de la surface est absorbée par la goutte
d’eau est ensuite répartie sur la surface de celle-ci
en une couche mince. Lorsqu’une goutte ainsi char-
gée de poussière sèche sur la surface, les petites
particules de poussière se concentrent sur sa sur-
face limitrophe d’avec la surface. Elles y restent sous
la forme d’un anneau de poussière qui peut être per-
çu par l’oeil humain (g. 7a). Sur des surfaces non
traitées, la polarité induit un état plus ou moins hyd-
rophobe, dans lequel la poussière est partiellement
entraînée. Toutefois en séchant, les gouttes laissent
la poussière dans des traces typiques en forme de
larmes (g. 7b). Dans le cas de surfaces superhy-
drophiles, le séchage de la pellicule d’eau chargée
de poussière laisse une couche uniforme de parti-
cules de poussière que l’oeil humain peut difcile-
ment discerner (g. 7c). On tire déjà parti de cette
propriété d’autonettoyage sur les surfaces en verre
de fenêtres, miroirs et les carreaux en céramique.
Fig. 7 : Comportement de surfaces superhydrophobe
(à gauche), hydrophobe (au milieu) et superhydrophile
(à droite)
Structure de
la surface
 6
6
1
/
6
100%



![III - 1 - Structure de [2-NH2-5-Cl-C5H3NH]H2PO4](http://s1.studylibfr.com/store/data/001350928_1-6336ead36171de9b56ffcacd7d3acd1d-300x300.png)