2013Structures de régulation du médicament

Structures de régulation du
médicament
L1 UE6 2014

Agence Nationale de Sécurité du Médicament
et des produits de santé (ANSM)

Création de l’InVS
(1998)
XXème siècle
Effets tératogènes
du thalidomide
en Allemagne
(1957)
Création de la Food and
Drug Administration (FDA)
Par F.D. Roosevelt
(1938)
Pure Food and
Drug Act
(1906)
Loi Française
sur l’inspection
des pharmacies
(1908)
Création de
l’AMM en
France
(1967)
Création de l’Agence du
Médicament en France
(1993)
Création de l’EMEA
(1995)
Création du système de
pharmacovigilance
(1974)
Création de l’AFFSaPS
en France (1999)
Création de l’ANSM
En France (2011)
Création de la HAS
(2004)

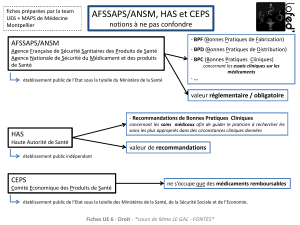
Agence Nationale de Sécurité du Médicament
et des produits de santé (ANSM)
Établissement public créé en Déc 2011
Sous la tutelle du ministère chargé de la santé
143-147 Bd Anatole France à Saint-Denis (93),
www.ansm.sante.fr
Elle a repris les missions, droits et obligations de
l’AFSSaPS. Elle a été dotée de responsabilités et
de missions nouvelles, de pouvoirs et de
moyens renforcés.

Agence Nationale de Sécurité du Médicament
et des produits de santé (ANSM)
Ses deux missions centrales :
Offrir un accès équitable à l’innovation
Garantir la sécurité des produits de santé tout
au long de leur cycle de vie, depuis les essais
initiaux jusqu’à la surveillance après
autorisation de mise sur le marché.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%