p⋅V =constante, T fixe

9. Loi de Boyle - Mariotte
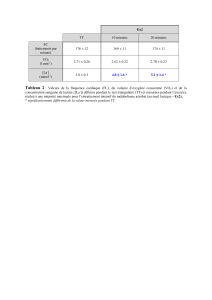
Un gaz est caractérisé par sa température T ( en K), sa pression p (en Pascal) et le volume V
( en m3 ) qu'il occupe. Ces trois grandeurs ne sont pas indépendantes et diverses expériences
permettent d'établir les relations qui les lient.
Dans l'expérience de Boyle-Mariotte, on maintient la température T constante et on varie
volume V et pression p.
Pour les gaz parfaits on obtient pour la relation entre V et p:
€
p⋅V=constante, !T fixe
C'est la loi de Boyle-Mariotte:
Unités de volume, pression, température.
• Volume V en m3.
1 m3 = 103 dm3 = 106 cm3 = 109 mm3 ; 1m3 = 103 litres
1 litre = 10-3 m3 = 1 dm3 = 1000 ml ; 1ml = 10-3 litres = 1 cm3 = 10-6 m3
• Pression p en Pa (pascals).
La pression est définie comme étant une force par unité de surface :
€
p (Pa)=F (N)
S (m2)
1 bar = 105 Pa = 103 hPa : Ceci correspond à la pression exercée par le poids d'un kg posé sur 1
cm2
1 atm = 1,013 bar = 1,013.105 Pa = 760 mmHg = 1013 hPa
• Température T en K (Kelvin)
La température notée T est la température absolue et est toujours ≥ 0. T = 0 représente le zéro
absolu. La température donnée par nos thermomètres se note
θ
et est mesurée en °C. On a la
relation :
T = 273 +
θ
θ
=
Τ
− 273
Exercices :
1. Quelle masse approximative faudrait-il poser sur une surface de 1 cm2 pour que la pression exercée par la
masse soit équivalente à la pression normale (1 atm)? Rép. 1 kg
2 Comment varie la pression d'un gaz lorsqu'on double son volume ?
3. Un gaz occupe un volume de 1 litre à la pression de 1000 hPa. Que vaut son volume si la pression passe à
800 hPa? Rép. 1,25 litre
4. Un gaz occupe un volume de 1 litre à la pression de 1000 hPa. Que vaut sa pression si son volume passe à 2
litres? Rép. 500 hPa
5. Une voiture fonctionnant au gaz naturel (méthane) a un réservoir d'environ 50 litres contenant du gaz à une
pression de 230 bars. (a) Calculer le volume que le gaz occuperait s'il était à la pression ambiante (b) Pour
mieux visualiser ce volume, que vaudrait le rayon d'une sphère de même volume?
Rép. 11,5.103 l ; 2,25 m
6. Une seringue de 100 ml est remplie d'air à la pression atmosphérique (950 hPa). On pousse le piston pour
réduire le volume de 40 ml. Quelle pression faut-il exercer? Si le diamètre de la seringue est de 2 cm, quelle
force faut-il pour cela? Rép. 1,56 atm

10. Loi de Charles et zéro absolu
Lorsqu'on mesure la pression p d'un gaz en fonction de sa température
θ
- le volume restant
fixe, on obtient une relation linéaire entre ces deux grandeurs. On remarque, de plus, que pour
une certaine température la pression du gaz s'annule : on a alors atteint le zéro absolu.
Il est utile de changer d'échelle des températures et d'introduire la température absolue T (en
K). Ainsi on a toujours T > 0.
Loi de Charles (parfois appelée loi de Gay-Lussac):
Elle s'exprime comme
€
p=a⋅
θ
+p0
(voir la droite ci-dessous). La pression s'annule pour une
température
θ0
, négative en °C, donnée par
€
θ
0=−p0
a
où p0 est l'ordonnée pour
θ
=0°C et a
est la pente de la droite.
p
θ °C
p0
T0
p
T (K)
A
En considérant le graphique de la pression en fonction de la température absolue, on constate
que
€
p0/T0=p/T
et qu'on peut encore écrire cette loi de la façon suivante :
€
p
T=constante, !V fixe
Gaz parfait :
A partir des expériences de Boyle-Mariotte, de Charles et de Gay-Lussac, on peut montrer
que la relation entre pression, volume et température d'un gaz parfait est donnée par :
€
p⋅V
T=n⋅R
ou
€
p⋅V=n⋅R⋅T
où n est le nombre de moles de gaz et R est la constante des gaz qui vaut
€
R=8,31 J/K⋅mol

Exercices :
A. Volume fixe (loi de Charles)
1. Un gaz est enfermé dans un récipient rigide à la pression de 950 hPa et sa température est de 20°C.
a) Que vaut sa pression si la température passe à 40°C ? Rép. 1015 hPa
b) Que vaut sa pression si la température passe à 0°C ? Rép. 885 hPa
c) Que doit valoir la température pour que la pression double ? Rép. 313°C
2. Un gaz est enfermé dans un volume donné, sa pression valant 500 hPa et sa température 20°C.
(a) Que doit valoir la température pour que la pression tombe à 250 hPa? Rép. -127°C
(b) Que vaut la pression si la température passe à 100°C? Rép. 636 hPa
B. Température fixe (loi de Boyle-Mariotte)
3. Un gaz (de l'air) a initialement un volume de 30 ml et une pression de 200 hPa. Sa température reste
constante et vaut 20°C.
(a) On double le volume. Que vaut alors la pression? Rép. 100 hPa
(b) La pression passe à 250 Pa. Que vaut le volume? Rép. 24 ml
C. Pression fixe (loi de Gay-Lussac)
4. Un gaz (de l'air) a initialement un volume de 30 ml et une pression de 200 hPa qui restera fixe. Sa
température vaut initialement 20°C.
(a) La température est augmentée à 60°C. Que vaut alors le volume? Rép. 34 ml
(b) La température passe à 0°C. Que vaut le volume? Rép. 28 ml
(c) On aimerait doubler le volume initial. Quelle doit être alors la température du gaz? Rép. 313 °C
D. Gaz parfaits
5. Un gaz (de l'air) a initialement un volume de 30 ml et une pression de 200 hPa. Sa température vaut 20°C.
(a) Combien de moles d'air sont contenues dans ce volume d'air? Rép. 0,246.10-3 mol
(b) La masse d'une mole d'air est de 29 g. Quelle masse de gaz y a-t-il dans le volume précédent?
Rép. 0,0071 g.
6. On enferme une mole d'air à 0°C dans un volume de 1 m3.
(a) Combien y a-t-il de molécules d'air dans ce volume?
(b) Quelle est la pression de l'air dans ce volume? Rép. 2,27 kPa
7. Estimer le nombre de moles d'air qu'il y a dans une salle de classe (dimension: 6 X 6 X 3 m3), la
température y étant de 24°C et la pression atmosphérique de 980 hPa. Quelle masse d'air cela représente-
t-il? Rép. 4,29.103 mol ; 124 kg
E. Divers
8. De l'air (gaz parfait) est enfermé dans un récipient de 100 ml à 20°C et une pression de 980 hPa. On
chauffe l'air à 80°C. (a) Que vaut alors la pression? (b) Quelle est la masse d'air contenue dans le
récipient? Rép. 1'180 hPa ; 0,117 g
9. Un gaz parfait est contenu dans un récipient, sa température valant –40°C. On le chauffe de manière à
doubler à la fois son volume et sa pression. Quelle est alors la température de ce gaz? Rép. 659°C
10. Quelle est la masse d'air occupant un volume de 2 litres à une pression de 1 bar et une température de
27°C ? Rép. 2,33 g
11. Quel est le volume occupé par 1 g d'air à 20°C et à pression normale? Rép. 0,829 l
1
/
3
100%