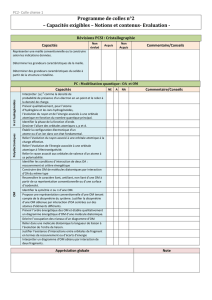
CQ1 – Description quantique de l`atome

Cours CQ1 – J. Joubert – PC* – Lycée J. B. Corot, Savigny-sur-Orge
CQ1 – Description quantique de l'atome
1. Fonction d'onde électronique
1.1. Ordres de grandeurs
1.2. Quantification
1.3. Densité électronique
2. Atome d'hydrogène
2.1. Orbitales atomiques
2.2. Représentations graphiques et extension spatiale
2.3. Énergie et spatialité
2.4. Ions hydrogénoïdes
3. Atomes polyélectroniques
3.1. Charge nucléaire effective
3.2. Extension spatiale et électronégativité
3.3. Densité électronique et interaction de London

Cours CQ1 – J. Joubert – PC* – Lycée J. B. Corot, Savigny-sur-Orge
Une idée de la probabilité de trouver de la matière à une distance r du noyau pour les premières orbitales de
l'atome d'hydogène regroupées par type s, p, d et f.

Cours CQ1 – J. Joubert – PC* – Lycée J. B. Corot, Savigny-sur-Orge
Orbitale 1s de l'atome d'hydrogène.
2s 2p
x
2p
y
2p
z
Orbitales 2s et 2p de l'atome d'hydrogène (à la même échelle que l'orbitale 1s précédente) :
surfaces iso-densité

Cours CQ1 – J. Joubert – PC* – Lycée J. B. Corot, Savigny-sur-Orge
orbitale 3d
xy
orbitale 3d
yz
orbitale 3d
xz
orbitale 3d
z²
orbitale 3d
x²-y²
Orbitales 3d de l'atome d'hydrogène (échelle réduite par rapport aux précédentes) :
surfaces iso-densité
Énergie des orbitales de l'atome d'hydrogène en fonction de leur rayon (1 eV = 1,6.10
−19
J)

Cours CQ1 – J. Joubert – PC* – Lycée J. B. Corot, Savigny-sur-Orge
Pour la curiosité :
Opérateur hamiltonien modèle pour un atome à N électron :
43421
321
321
43421
orbite-spin
couplage
roniqueinterélect
répulsion
noyaux-électrons attraction
cinétique énergie
∑∑∑∑
==>==
++−∇
−
=
N
iiii
N
ji ij
N
iiM
M
N
ii
sl
rr
z
H
1111
2
..
1
21
ξ
La fonction d'onde électronique totale
ϕ
vérifie H
ϕ
= E
ϕ
avec E l'énergie électronique totale.
Dans l'approximation orbitalaire, on décompose
ϕ
comme un produit antisymétrique de
fonctions mono-électroniques (pour respecter le principe de Pauli), chacune étant le produit
d'une orbitale atomique et d'une fonction de spin : X
i
= χ
i
.s
i
( )
(
)
(
)
(
)
( )
( ) ( ) ( )
NXXX
X
NXXX
N
NNN
L
M
MOM
L
21
1
21
,...1
2
111
=
ϕ
Orbitales de type f :
 6
6
1
/
6
100%