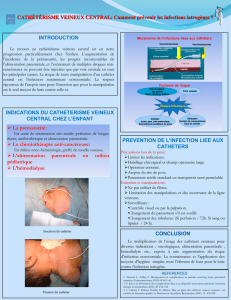
Risques infectieux associés aux dispositifs médicaux

IATROGÉNIE
Revue FRancophone des LaboRatoiRes - novembRe 2010 - n°426 // 51
article reçu le 31 mai, accepté le 30 août 2010.
© 2010 – Elsevier Masson SAS – Tous droits réservés.
a Equipe opérationnelle en hygiène hospitalière
b Service de réanimation médicale
Centre hospitalier universitaire Ambroise-Paré (AP-HP)
9, av. Charles-de-Gaulle
92104 Boulogne cedex
* Correspondance
florence.espinasse@apr.aphp.fr
1. Introduction
En 2006, parmi les 180 000 patients hospitalisés en court
séjour dans les établissements de santé français et inclus
dans l’enquête nationale de prévalence des infections noso-
comiales, 43,5 % étaient porteurs d’au moins un dispositif
invasif (cathéter vasculaire, sonde vésicale, sonde endo-
trachéale ou trachéotomie). Ce pourcentage de patients
exposés atteignait 75 % dans les centres de lutte contre
le cancer et 90 % dans les services de réanimation [1].
Ces dispositifs invasifs sont donc incontournables, au moins
à titre provisoire, dans la prise en charge d’un patient mais
leur présence s’accompagne d’événements indésirables
parmi lesquels les complications infectieuses occupent
une place prépondérante chez les patients les plus fragiles.
Les arguments microbiologiques, souvent quantitatifs, sont
fondamentaux dans les dénitions retenues pour la sur-
veillance épidémiologique des infections associées à ces
dispositifs invasifs [2]. À partir de prélèvements recueillis
dans des conditions précises et à la lumière de renseigne-
ments cliniques, le rôle du microbiologiste est de fournir
les éléments nécessaires pour établir la colonisation du
dispositif, aider à déterminer son imputabilité éventuelle
dans le processus infectieux ou participer au système de
surveillance épidémiologique de l’établissement.
Summary
Device-associated infection risk
Intravascular catheterization, urinary catheteriza-
tion, and assisted breathing, are critical to modern
medicine. Most patients admitted to a hospital are
exposed to one or more of these medical invasive
procedures at some point during the course of their
treatment. However, the introduction of vascular,
urinary or endotracheal catheter is linked to a signi-
cant increase in infection risk. An estimated 60% of
Healthcare Associated Infections (HAI) is thought to
be related to the use of such invasive devices. The
pathogenesis of these infections is strongly corre-
lated with a biolm formation on the surfaces of the
foreign materials.
The most commonly occurring device-associated
infections are intravascular catheter-associated bac-
teremia, catheter-associated urinary tract infections
and ventilator-associated pneumonia which are all
considered to be in part preventable.
Epidemiological denitions of these infections include
both clinical symptoms and microbiological criteria.
Microbiology lab assistance is needed to monitor the
ratio of infection incidence to the number of days the
device was used. Monitoring is critical to managing
the risk of infection associated to these invasive de-
vices and to evaluating preventive efforts based on
standard precautions, specic measures and sensible
use of these medical devices.
Catheter – indwelling urinary catheter – endotracheal
tube – Healthcare Associated Infection intravascular
catheter-associated bacteremia – catheter-associated
urinary tract infection ventilator-associated pneumonia.
réSumé
L’abord vasculaire, le drainage urinaire ou la ventilation assistée sont
indispensables à la médecine actuelle et, durant leur prise en charge, la
plupart des malades hospitalisés sont exposés à l’un ou l’autre de ces
actes. Cependant, l’implantation temporaire d’un cathéter vasculaire,
d’une sonde vésicale ou d’une sonde endotrachéale est associée à un
risque infectieux non négligeable puisqu’on estime que 60 % des infec-
tions associées aux soins auraient pour origine un dispositif invasif. La
physiopathologie de ces infections est étroitement liée à la constitution
d’un biolm sur ces corps étrangers.
Parmi celles-ci, les bactériémies associées aux cathéters vasculaires, les
infections urinaires associées au sondage vésical et les pneumopathies
acquises sous ventilation mécanique sont les plus fréquentes et sont
considérées comme en partie évitables.
Ces infections répondent à des dénitions épidémiologiques associant
arguments cliniques et critères microbiologiques. La collaboration du
laboratoire de microbiologie est essentielle pour suivre l’évolution de l’in-
cidence de ces infections rapportée au nombre de jours d’exposition au
dispositif. Cette surveillance est indispensable à la gestion du risque infec-
tieux associé à ces dispositifs invasifs et à l’évaluation des programmes
de prévention qui reposent sur les précautions standard, des mesures
spéciques et un usage raisonné de ces procédures.
Cathéter – sondage vésical – ventilation mécanique – infection associée
auxdispositifs invasifs – pneumopathie – bactériémie liée au cathéter –
infection urinaire sur sonde.
Florence Espinassea,*, Bernard Pageb, Brigitte Cottard-Boullea
Risques infectieux associés
auxdispositifs médicaux invasifs

Dossier scientifique
52 //
Revue FRancophone des LaboRatoiRes - novembRe 2010 - n°426
(bactéries, levures, autres ?), qui vont y vivre en symbiose
ou en coopération. Puis, à la phase de consolidation et
de maturation du biolm, ces microorganismes secrètent
la matrice d’exopolysaccharides qui formera la structure
tridimensionnelle protectrice, à l’intérieur de laquelle, par
le quorum-sensing, les bactéries vont coordonner leur
comportement. Enn, c’est la phase d’érosion : des bac-
téries sessiles sont libérées sous forme de micro-emboles
septiques et vont coloniser d’autres sites [3].
Les conséquences médicales sont majeures. 1/ Le biolm
limite la réaction immunitaire locale par défaut de pénétra-
tion des anticorps et des cellules phagocytaires. Mais ces
dernières libèrent leurs facteurs microbicides, induisant une
réponse inammatoire chronique dans les tissus entourant
le dispositif. 2/ Les bactéries dans les couches profondes
du biolm sont en dormance, donc incapables de se diviser,
avec pour effets une mauvaise sensibilité des diagnostics
microbiologiques par culture et une résistance élevée
aux antibiotiques actifs sur la bactérie en division avec
augmentation des concentrations minimales inhibitrices
d’un facteur 100 ou 1 000. Ceci explique que la réussite de
traitement d’une infection associée à un dispositif invasif
est très souvent conditionnée par l’ablation du dispositif.
3. Risque infectieux associé
aux cathéters vasculaires
Disposer d’un abord vasculaire est essentiel pour la prise
en charge des patients relevant de la réanimation, la cancé-
rologie, ou de l’hémodialyse… L’implantation d’un cathéter
vasculaire permet la réalisation rapide d’une expansion
volémique, l’administration de médicaments, de nutrition
parentérale ou de produits sanguins, ainsi que la surveillance
Après un bref aperçu sur le lien entre dispositif invasif
et biolm, nous aborderons successivement les risques
infectieux associés au cathétérisme vasculaire, au sondage
vésical, puis à l’intubation trachéale.
2. Dispositifs invasifs et risque
infectieux : le biofilm
L’OMS estime qu’entre 5 et 12 % des patients hospitali-
sés dans le monde développent une infection associée
aux soins (IAS) dont plus de 60 % sont associées à l’im-
plantation d’un dispositif médical ou chirurgical [3]. Tout
dispositif, implanté à titre provisoire ou permanent, peut
devenir le site d’une éventuelle infection (sonde urinaire,
canule d’intubation, valve cardiaque, prothèse vasculaire
ou orthopédique, dispositif intra-utérin, etc.). La physiopa-
thologie de ces infections est liée initialement à la consti-
tution d’un biolm sur ces corps étrangers.
Le biolm est une communauté plurimicrobienne se xant
à une surface inerte ou vivante et maintenue enchâssée
sur cette surface par la sécrétion d’une matrice adhésive
et protectrice. C’est une structure vivante, dynamique,
en perpétuel remaniement qui constitue le mode de vie
majoritaire des microorganismes, ainsi sédentarisés, par
opposition à la phase planctonique. Même si les techniques
aseptiques sont scrupuleusement respectées lors de l’im-
plantation du dispositif, le développement du biolm est
rapide et inéluctable sur la plupart des matériaux utilisés
à l’heure actuelle en médecine humaine. Schématique-
ment, la première étape est le dépôt, sur ce dispositif, de
substances organiques fonction du milieu (bronectine,
brinogène, collagène, protéines urinaires) qui font le lit
de l’adhésion d’une ou plusieurs espèces microbiennes
TableauI – Les cathéters vasculaires usuels.
Type de dispositif
vasculaire
Site anatomique d’insertion
et spécificités éventuelles
Durée moyenne de
maintien habituellement
observée1
Taux de bactériémie associée
au cathéter/1 000 jours
d’exposition2
Cathéter veineux
périphérique
Veines de l’avant-bras, de la main ou du pied chez le
nouveau-né
Très courte
2 à 4 jours 0,5 [0,2 - 0,7]
Cathéter artériel
périphérique
Artère radiale ou fémorale.
Monitorage des paramètres hémodynamiques et
accès vasculaire pour prélèvements répétés de gaz
du sang
Courte 1,7 [1,1 - 2,3]
Cathéter veineux central
Inséré dans des conditions d’asepsie chirurgicale
dans la veine sous-clavière, jugulaire interne, ou
fémorale
Courte 2,7 [2,6 - 2,9]
Cathéter veineux central
dedialyse, non tunnellisé
Insertion fémorale ou jugulaire interne d’un cathéter
à double lumière Courte 4,8 [4,2 - 5,3]
Cathéter veineux central
inséré par voie périphérique
(PICCline)
Inséré dans la veine basilique ou céphalique, au
dessus du pli du coude, sous contrôle radiologique,
jusqu’à la veine cave supérieure pour un traitement
parentéral de longue durée
Longue
(jusqu’à 6 mois) 1,1 [0,9 - 1,3]
Cathéter veineux central
tunnellisé (type Canaud,…)
Insertion chirurgicale en vue d’une hémodialyse
d’une durée prévisible > 3 semaines dans l’attente
éventuelle d’une stule artérioveineuse fonctionnelle
Longue
(jusqu’à 18 mois) 1,6 [1,5 - 1,7]
Chambre à cathéter
implantable ou chambre
de perfusion veineuse
ou«PAC»
Accès veineux profond inséré chirurgicalement pour
traitement répété de longue durée > 3 mois, ou
veinotoxique ou en absence de capital veineux
Longue
(jusqu’à plusieurs
années)
0,1 [0,0 - 0,1]
1. Fonction des recommandations, de la nécessité du cathéter et de sa fonctionnalité.
2. Selon Maki et.al [11].

IATROGÉNIE
Revue FRancophone des LaboRatoiRes - novembRe 2010 - n°426
// 53
• La colonisation intraluminale du cathéter a pour origine
l’introduction de microorganismes dans la lumière du
cathéter à partir du connecteur lors de la manipulation des
raccords sur la ligne veineuse (injection, déconnexion) ou
par une préparation injectable contaminée. Elle devient
prépondérante pour les cathéters maintenus au-delà de
4 jours (CVP) ou de 7-10 jours (CVC). C’est le mécanisme
le plus fréquent pour les chambres à cathéter implantables
en raison des injections itératives dans le réservoir après
passage à travers la barrière cutanée.
• La colonisation de la portion intravasculaire du cathéter
peut également se faire par voie hématogène secondaire-
ment à un ou des épisodes bactériémiques occasionnés
par la présence d’un foyer infectieux à distance (urinaire,
pulmonaire, chirurgicale, digestive ou autre). Elle est consi-
dérée comme rare (< 10 %).
cardio-vasculaire et le maintien d’une voie d’accès veineux
en situation d’urgence.
Seront traités ici les cathéters veineux ou artériels, intro-
duits par voie périphérique ou centrale. Ainsi, en France,
seraient mis en place chaque année 110 000 chambres à
cathéter implantables, 1 million de cathéters centraux vei-
neux (CVC) et artériels [4] et 25 à 30 millions de cathéters
veineux périphériques (CVP) [5].
Les complications liées aux cathéters vasculaires ont des
conséquences parfois majeures, d’une part pour l’abord
vasculaire considéré, et d’autre part, pour le patient lui-
même (allongement de la durée de séjour, retard du pro-
gramme thérapeutique, nouvelle ponction, localisation
secondaire de l’infection…). Outre les infections, locales ou
systémiques, potentiellement sévères, ces gestes invasifs
peuvent s’accompagner de complications mécaniques
(pneumothorax, trajet aberrant, migration surtout pour
les voies centrales), qui, elles-mêmes, aggraveront les
risques de complications thrombotiques ultérieures (phlé-
bite, sténose, thrombose…). Ainsi, toutes causes et tout
degré de gravité confondus, la fréquence des complica-
tions du cathétérisme central concernerait plus de 15 %
des patients [6].
Les complications liées à ces gestes invasifs sont en partie
évitables et justient les programmes de prévention liés
à ce type d’actes s’appuyant sur des recommandations
consensuelles pondérées.
Les caractéristiques de quelques cathéters vasculaires
sont résumées dans le tableau I.
3.1. Définitions des infections associées
aux cathéters vasculaires (figure 1)
Les dénitions des infections associées aux cathéters
vasculaires (ILC) présentées dans la figure 1 sont celles
applicables à la surveillance épidémiologique en France
depuis 2007 [2]. Elles diffèrent des dénitions cliniques
usuelles et ne correspondent pas exactement à celles du
CDC rendant délicate toute comparaison entre les études
épidémiologiques publiées dans la littérature internationale.
3.2. Physiopathologie des infections
associées aux cathéters vasculaires
Comme pour tout dispositif implanté, dans les 24 heures
suivant l’insertion du cathéter dans l’organisme, débute
la constitution du biolm à l’origine d’infections locales
et/ou systémiques.
Schématiquement, trois voies d’acquisition des microorga-
nismes sont décrites dont les deux premières se succèdent
pour un cathéter de longue durée (figure 2).
• La colonisation par voie extraluminale du cathéter est le
mécanisme le plus fréquemment évoqué pour les cathéters
à émergence cutanée, dans les premiers jours suivant la
pose. Les bactéries des ores du patient, cutanée surtout
ou oropharyngée, du professionnel, ou provenant d’un anti-
septique contaminé migrent via le site d’insertion, suivant la
surface externe du cathéter, le long du trajet sous-cutané.
Cette contamination peut aussi survenir secondairement
lors de la réalisation des pansements du site d’insertion.
En ce qui concerne les CCI, ce mécanisme est secondaire
à cause de leur implantation chirurgicale dans une loge
hermétique sous-cutanée.
Figure 1 – Critères de définition des infections
associées auxcathéters [2].
Signes infectieux LOCAUX
Bactériémie liée au cathéter
Infection générale liée au cathéter
Infection locale liée au cathéter
ET
Hémocultures positives dans les 48 heures encadrant le retrait du cathéter
(ou la suspicion diagnostique si le cathéter n’est pas retiré d’emblée)
CVC ou assimilé ≥ 103 UFC/mL
ousite d’insertion positif
Bactériémie liée au CVC
ou assimilé
CVP ≥ 103 UFC/mL
Bactériémie liée au CVP
Soit hémocultures
appariées positives:
délai > 2h
ou ratio > 5
Soit pus au site
d’insertion du CVP en
absence d’autre porte
d’entrée identiée
Soit culture
ducathéter positive
avec le même
microorganisme
Infection générale liée au CVC ou assimilé
Et signes infectieux GENERAUX régressant dans les 48 heures
suivant l’ablation du cathéter
Infection générale liée au CVP
Culture du cathéter ≥ 103 UFC/mL
Purulence orice CVC
et/ou tunnellite
CVC
Et CVC ≥ 103 UFC/mL
(ou assimilé)
Infection locale liée
au CVC ou assimilé
CVP
Soit CVP
≥ 103
UFC/mL
Soit pus au
site d’insertion
duCVP et
culture positive
Infection locale liée au CVP
Soit
absence
de culture

Dossier scientifique
54 //
Revue FRancophone des LaboRatoiRes - novembRe 2010 - n°426
Des patients hospitalisés hors réanimation sont également
porteurs de CVC. Une étude réalisée dans 29 services de
soins allemands montre un ratio d’exposition de 4,6 jours-
CVC/100 journées d’hospitalisation avec une incidence
des bactériémies associées de 4,3/1 000 jours-CVC [10].
Ces infections sont potentiellement graves. L’allongement
de la durée de séjour en réanimation liée aux bactériémies
associées aux CVC varie de 4 à 19 jours. Malgré les difcul-
tés liées aux facteurs confondants, la mortalité attribuable
à ces bactériémies associées aux CVC est estimée à 10 à
20 % des patients [4]. Pour le système de santé, le surcoût
lié au traitement et à l’allongement de la durée de séjour
attribuable à une bactériémie nosocomiale associée au
CVC est estimé en France entre 7 730 et 11 390 euros par
cas, soit par an 100 à 130 millions d’euros.
• Cathéters veineux périphériques
Le cathéter veineux périphérique est le dispositif invasif le
plus utilisé dans les établissements de santé. En France
en 2006, 28 % des patients hospitalisés depuis au moins
24 heures en médecine, et 40 % en chirurgie ou en réani-
mation étaient porteurs d’un CVP [7]. Sa pose est devenue
un geste fréquent et banal, à tel point que la pertinence du
geste et la justication du maintien du dispositif peuvent
constituer un axe de prévention des ILC.
Le risque infectieux associé aux CVP est perçu comme
faible mais probablement sous-estimé par manque de
documentation microbiologique (cultures du cathéter et/
ou du site d’insertion non réalisées), manque de spécicité
des signes locaux (rougeur et/ou douleur et/ou induration
et/ou cordon veineux) à la fois témoignant possiblement
d’un phénomène irritatif/inammatoire (phlébite) ou d’un
phénomène infectieux, et enn une courte durée d’expo-
sition, avec résolution spontanée de l’infection à l’ablation
du CVP. Dans les études comparatives, le risque d’infection
systémique associé au CVP est inférieur à celui associé
au CVC. L’incidence des bactériémies associées aux CVP
varie de 0,5 à 0,7 pour 1 000 jours CVP (tableau I) [11,
12] et 5 % des bactériémies nosocomiales avaient un CVP
comme porte d’entrée, documentée dans 47 % des cas [7].
3.3. Épidémiologie des infections
associées aux cathéters vasculaires
3.3.1. Description
Les cathéters vasculaires sont, à égalité avec le site urinaire,
les premières causes des bactériémies nosocomiales dans
la dernière enquête française (2004) incluant plus 10 mil-
lions de journées d’hospitalisation dans 286 établissements
de santé. Ils sont à l’origine d’1 bactériémie sur 5, dont la
moitié liée aux cathéters veineux centraux (tableau II) [7].
• Cathéters veineux centraux
Ces dispositifs sont fréquents. En court séjour, 8,4 % des
patients hospitalisés depuis au moins 24 h étaient por-
teurs d’un cathéter veineux central le jour de l’enquête
de prévalence [1]. L’étude d’incidence réalisée dans 165
réanimations françaises volontaires incluant 22 927 patients
hospitalisés en réanimation plus de 48 heures montrent
qu’un cathéter veineux central est mis en place chez 60 %
des patients adultes, pour une durée moyenne de maintien
de 10 jours. L’incidence moyenne des infections locales,
générales ou systémiques associées aux CVC (ILC/BLC)
dans cet échantillon était de 2,31/1 000 jours CVC dont
0,97 bactériémies associées aux CVC/1 000 jours CVC [8].
Aux États-Unis, les données 2006-2008 du National
Healthcare Safety Network (NHSN) (2 461 réanimations,
> 6 millions jours-CVC surveillés) font état d’incidences
moyennes de bactériémies associées aux cathéters cen-
traux, comparables, variant de 1,3 (réanimation pédiatrique)
à 5,5 bactériémies/1 000 jours-CVC (réanimation brûlés) [9].
Tableau II – Fréquence relative des portes d’entrée
de 4 548 bactériémies nosocomiales1,
RAISIN 2004 [7].
Porte d’entrée suspectée n %
Urinaire 946 20,8
Foyer digestif 574 12,6
Cathéter central 507 11,1
Pleuro pulmonaire 434 9,5
Cutanée 306 6,7
ISO 249 5,5
Cathéter veineux périphérique 233 5,1
Chambre à cathéter implantable 209 4,6
Autre 208 4,6
Neutropénie sans porte d’entrée 146 3,2
Inconnue chez un patient non neutropénique 706 15,5
Non renseignée 30 0,7
1. Nosocomiales: patient hospitalisé depuis plus de 48 heures au moment de
l’épisode bactériémique.
Figure 2 – Cathéter vasculaire: principales voies
d’acquisition des microorganismes.

IATROGÉNIE
Revue FRancophone des LaboRatoiRes - novembRe 2010 - n°426
// 55
3.4.1 Conditions optimales de prélèvement
Cette phase pré-analytique est souvent déléguée dans
les établissements de santé à divers professionnels habi-
lités (médecin, inrmier) différents du biologiste ou de
ses collaborateurs. La multiplicité des acteurs potentiels
accroît les risques de contamination des prélèvements,
et complique la distinction entre infection, colonisation
ou contamination. Mermel et coll. recommande de dédier
une équipe transversale aux prélèvements et aux soins
des cathéters vasculaires [13], ou plus simplement, il est
nécessaire de former les professionnels aux conditions
optimales de prélèvements.
• Avant le prélèvement des hémocultures par ponction
veineuse périphérique et pour éviter la contamination
par la ore cutanée, la préparation de la peau du malade
doit être réalisée en 4 temps : détersion au savon, rinçage
au sérum physiologique stérile, séchage, application d’un
antiseptique de préférence alcoolique en respectant le
temps de contact de l’antiseptique avant la ponction, sans
omettre la désinfection du bouchon des acons.
• Avant prélèvement des hémocultures sur un cathéter
vasculaire, si le volume « mort » jusqu’au premier raccord
est important, il est souhaitable de l’éliminer par une purge
préalable pour ne recueillir que le contenu du cathéter.
Après un prélèvement, il est recommandé de rincer les
chambres à cathéter implantables en injectant 10 ml sérum
physiologique stérile par saccades [15].
• L’ablation du pansement est suivie de l’écouvillonnage
du site d’insertion. Certains pansements de cathéters (ou
« patchs »), imbibés de chlorhexidine et/ou d’ions argent,
pourraient perturber la abilité des résultats de ces écou-
villonnages cutanés mais aucune étude comparative n’est
publiée à ce sujet.
• L’ablation du cathéter doit se faire stérilement, et son
extrémité distale (la totalité de la partie insérée pour les
cathéters courts, 5 cm pour les cathéters longs) coupée
et adressée au laboratoire. Avant ablation du cathéter, les
techniques de préparation de la peau sont discutées. Le
cathéter peut être contaminé au passage au travers du site
d’insertion, mais l’usage d’un antiseptique majeur peut
inhiber la culture microbienne. Dans le protocole Réa-RAI-
SIN, la technique d’ablation suivante est recommandée :
appliquer avant l’ablation soit de l’alcool simple soit du
savon antiseptique/rinçage/séchage [7].
Une estimation des risques de bactériémies associées
aux autres cathéters vasculaires gure dans le tableau I.
3.3.2. Microbiologie des infections
associées aux cathéters vasculaires
Pour les cathéters à émergence cutanée, les microorga-
nismes les plus fréquemment impliqués dans les bacté-
riémies associées sont principalement ceux de la ore
cutanée, essentiellement les staphylocoques à coagulase
négative (38 %) puis les Staphylococcus aureus (27 %),
les Candida sp. et les entérobactéries (tableau III) [7,
13]. En réanimation, après les cocci à Gram positif (49 %),
entérobactéries (28 %) et Pseudomonas aeruginosa (13 %)
occupent une place non négligeable parmi les microor-
ganismes responsables des colonisations des CVC [8].
Pour les cathéters implantés chirurgicalement et les cathé-
ters centraux à insertion périphérique (PICCline), sont isolés
par ordre de prévalence, les staphylocoques à coagulase
négative, les entérobactéries puis Staphylococcus aureus
et Pseudomonas aeruginosa [13].
3.3.3. Facteurs de risque des infections
associées aux cathéters vasculaires
À côté des facteurs de risque liés au malade, difcilement
contrôlables, tels que les âges extrêmes, le sexe masculin,
l’immunodépression, la dénutrition (…), ont été identiés des
facteurs liés à la pose du cathéter tels que les conditions
de pose et l’expérience de l’opérateur, le site d’insertion
choisi, le matériau du cathéter et ceux liés à son utilisa-
tion : durée du cathétérisme, fréquence et conditions de
manipulations de la ligne veineuse, type de soluté perfusé
(composition, pH, osmolarité, débit de perfusion) [11, 14].
3.4. Diagnostic microbiologique
des infections associées
auxcathéters vasculaires
L’apport de la microbiologie est indispensable pour docu-
menter l’implication du cathéter vasculaire dans le proces-
sus infectieux, exclure la responsabilité d’un autre foyer
infectieux et contribuer à la prise en charge optimale de
l’épisode, en fonction de l’espèce bactérienne ou fongique
isolée. Elle est fondamentale pour afrmer la colonisation
des cathéters vasculaires centraux dans le cadre des
surveillances épidémiologiques mises en œuvre dans les
réanimations.
Tableau III – Fréquence relative des microorganismes isolés dans les bactériémies nosocomiales
à porte d’entrée potentiellement associée à un dispositif invasif, RAISIN 2004 [7].
Porte d’entrée (nombre) Staphylococcus
aureus
Staphylocoque
à coagulase
négative
Escherichia coli
Klebsiella,
Enterobacter,
Serratia
Pseudomonas
aeruginosa Autres
Urinaire
(n = 1 009) 7 3 52 15 6 17
Cathéter central
(n = 549) 27 40 3 9 5 17
Cathéter veineux périphérique
(n = 249) 37 33 4 12 4 10
Chambre à cathéter implantable
(n = 229) 17 38 5 11 7 22
Pleuro-pulmonaire
(n = 477) 22 9 9 18 14 28
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%