SAR Chimie - Sujet-Finalpopulaire

1
Stage d’accompagnement de rentrée
TD de Chimie
1. Chimie Générale
QCM 1. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. Deux nucléides ayant le même nombre de protons (Z) mais des nombres de neutrons différents
(N = A-Z) sont deux éléments différents.
B. La masse molaire en g/mol est égale a la masse atomique exprimé en u.m.a (d’un atome réel
de ce nucléide).
C. Le nombre de nucléon ou nombre de masse A est égale à : Z-N
D. Deux isotopes sont des nucléides ayant le même nombre de masse A mais des numéros
atomiques différents.
E. L’isotope du carbone 12
6C est un atome réel dont la masse est 12 u.
QCM 2. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. L’échelle de Pauling mesure (classe) l’électronégativité en prenant comme élément de réfé-
rence le fluor F = 4,0 (eV
1
2).
B. Le fluor est l’élément le plus électronégatif selon l’échelle de Pauling.
C. Dans une période si le numéro atomique Z augmente alors l’énergie d’ionisation diminue.
D. Dans une colonne lorsque le numéro atomique Z augmente l’énergie d’ionisation diminue.
E. L’électronégativité augmente de gauche à droite et de haut en bas dans le tableau périodique.
Question 3.
a. Quelles sont les 3 règles de remplissage des couches électroniques ?
b. Selon le principe de stabilité : A l’état fondamental, un atome se trouve dans son état éner-
gétique le plus stable correspondant a l’énergie la plus faible ?
c. Quelle relation définit en eV l’énergie de l’hydrogène ou d’hydrogénoïde (= un seul électron
mais Z différent de 1) ?
d. Quelles sont les 2 exceptions à la règle de Klechkowski ? Donner leur configuration électro-
nique.
QCM4. Le soufre S16 est situé sur la même colonne que l’oxygène O8dans la classification
périodique des éléments.
Indiquer la (les) proposition(s) exacte(s) :
A. EN (S16) > EN (O8).
B. Le soufre et l’oxygène possèdent le même nombre d’électrons de cœur.
C. Le soufre et l’oxygène ont des propriétés physico-chimiques voisines.
D. EN (S16) < EN (Cl17)
E. AE (S16) < AE (Cl17)

2
QCM 5. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. EI1(S16) < EI1(Cl17)
B. EI2(S16) < EI1(S16)
C. L’ion le plus probable du soufre est S 4+
D. L’ion le plus probable du soufre est S –
E. L’ion le plus probable du soufre est S 2 –
QCM 6. Le bore contient 2 isotopes : 10B et 11B. Sachant que la masse atomique du bore
naturel est M = 10,8 g/mol, calculer la proportion (en %) de chaque isotope :
A. % 10B = 0,8 % 11B = 0,2
B. % 10B = 0,65 % 11B = 0,35
C. % 10B = 0,2 % 11B = 0,8
D. % 10B = 0,35 % 11B = 0,65
E. % 10B = 0,35 % 11B = 0,65
Question 7. On considère la molécule ICl –
4. Ecrire la forme de Lewis envisageable pour cette
molécule.
QCM 8. Quelle est sa formulation VSEPR ?
A. AX4. Pyramide trigonale
B. AX4E2. Bipyramide trigonale.
C. AX4E2, Molécule plane carrée.
D. AX4, molécule coudée en forme de V.
E. Aucune des réponses précédentes n’est correcte.
On sait que le moment dipolaire de la liaison ICl vaut environ 0,8 Debye et que la longueur de
la liaison est de 2 Angstrôm. On rappelle que 1 Debye = 1
3.10−29C.m, e = 1,6.10−19.
QCM 9. Quel est le pourcentage de caractère ionique de la liaison ICl
A. Environ 4 %
B. Environ 8 %
C. Environ 12 %
D. Environ 16 %
E. Aucune des réponses proposées n’est correcte.
La magnésium a pour numéro atomique 12.

3
Question 10.
a. Donnez la configuration électronique du Magnésium.
b. Donnez cette même configuration en utilisant les cases quantiques.
c. En déduire la famille dans laquelle se trouve cet élément.
Il existe 3 isotopes du Mg : le 24Mg, présent à 79%, le 25Mg, présent à 10% et le 26Mg. Calculer
la masse atomique moyenne du Mg :
QCM 11.
A. 24 g.mol−1
B. 24,32 u.m.a
C. 24,46 u.m.a
D. 24,46 g.mol−1
E. 24,32 mg.mol−1
QCM 12. Considérons l’ion Mg 2+. Quel est la configuration électronique de cet ion ?
A. ↑↓ ↑↓ ↑↑ ↑↑ ↑↑
B. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
C. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
D. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
E. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
QCM 13. Indiquer la (les) proposition(s) exactes :
a. a. L’énergie d’ionisation du Sodium (Na) est plus faible que celle du Mg.
b. b. L’énergie d’ionisation de l’Hélium (He) est plus faible que celle du Mg.
c. c. L’électronégativité du Mg est plus forte que celle du Béryllium (Be).
d. d. L’électronégativité de l’Oxygène (O) est plus forte que celle du Mg.
Question 14. Ecrire la structure de l’azote puis représenter les orbitales atomiques.
QCM 15. Quelle sont les orbitales de valence correctes pour le Fer (Z= 26) ? (conseil :
écrire la structure pour ne pas se tromper) Quelles sont les règles qui ne sont pas respectées
pour les autres ?
A. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓
B. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
C. ↑↑ ↑↑ ↑↑ ↑↑ ↑↑ ↑ ↑ ↑ ↑ ↑↑
D. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↓ ↑ ↓ ↑↓
E. ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓ ↑↓

4
Question 16. On va admettre pour cet exercice que le Fer possède uniquement 2 isotopes
stables, Le Fer 56 (abondance : 85%) et un autre isotope de masse atomique inconnue. La
masse atomique moyenne du Fer est 55.7 uma. (Le Fer 56 possède une masse atomique
égale à son nombre de nucléons). Quelle est la masse atomique de l’autre isotope ?
QCM 17. En se servant de la théorie VSEPR, retrouver la géométrie correspondant
aux molécules suivantes ainsi que les géométries de base, vous préciserez également les
angles :
A.
B.
C.
D.
E.
2. Chimie Organique
QCM 1. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. Un atome de carbone chargé positivement (carbocation) est d’autant plus stable qu’il est
entouré de subsistants exerçant un effet mésomère attracteur (-M).
B. Un atome de carbone chargé négativement (carbanion) est d’autant plus stable qu’il est
entouré de substituants exerçant un effet inducteur attracteur (-I).
C. Un effet inductif concerne uniquement les électrons π.
D. Si un effet inductif attracteur s’oppose à un effet mésomère donneur, c’est toujours l’effet
inductif qui l’emporte.
E. Un carbocation est un carbone ayant gagné un doublet électronique.
QCM 2. Parmi les propositions suivantes concernant la molécule d’Allylestrenol ci-
dessous, indiquer celle(s) qui est (sont) exacte(s) ?
A. Cette molécule est constitué de 7 carbones asymétriques.
B. Cette molécule est constitué de 6 carbones asymétriques.
C. Elle est constitué de 21 carbones.
D. Sa formule brute est C21H32O
E. Sa formule brute est C20H32O

5
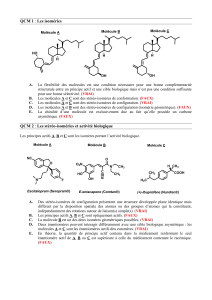
QCM 3. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. C et C’ sont des isomères de constitution.
B. C et C’ sont des isomères de squelette.
C. C et C’ sont des isomères de fonction.
D. La molécule C est un alcool primaire.
E. La molécule C’ a pour formule brute C5H11O
QCM 4. Voici deux acides aminés :
Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. Ces molécules sont isomères de conformation.
B. Ces molécules sont isomères de constitution.
C. Ces molécules présentent une isomérie de position.
D. Ces molécules présentent une isomérie de squelette.
E. On obtient la molécule 2 après rotation autour d’une liaison σ.
QCM 5. Parmi les propositions suivantes, indiquer celle(s) qui est (sont) exacte(s) ?
A. La molécule 1est chirale car elle possède 2 carbones asymétriques donc a 22=4 stéréoiso-
mères.
 6
6
 7
7
 8
8
1
/
8
100%