Ljungh, Wadström - Méthode Sorbact

ReRe Print
MEDIZIN &
PRAXIS
— Plaies Infectées —
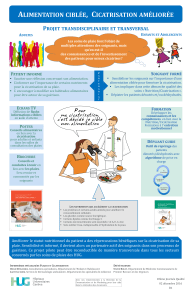
Un nouveau pansement
antibactérien sans agent
pharmacologique actif pour
le soin des plaies infectées
A. Ljungh, T. Wadström
© Copyright 2005 by Verlag für
MEDIZINISCHEPUBLIKATIONEN
Bernd von Hallern
Vogelsang 28, 21682 Stade
Germany

8 MEDIZIN & PRAXIS «INFECTED WOUNDS»
Les infections retardent la cicatrisation.
Elles sont provoquées par des micro-
organismes pathogènes qui pénètrent dans
la plaie, s'y multiplient et y produisent des
toxines qui agissent à la fois sur les tissus
de la plaie, et sur l'organisme dans son
ensemble. Les approches thérapeutiques
habituelles comprennent l’administration
d’une antibiothérapie systémique et d’un
traitement antiseptique topique. Les agents
actifs utilisés dans ce but peuvent
cependant avoir des effets secondaires sur
les cellules endogènes. L'action du
pansement Cutisorb®Sorbact®en revanche
repose sur le principe de l'interaction
hydrophobe, et nettoie la plaie par un
procédé purement physique sans effets
secondaires. Cet article explique le principe
de fonctionnement et les différents
facteurs intervenant dans la cicatrisation.
Infection des plaies et traitement des plaies
Après avoir colonisé les tissus, les microbes se multiplient dans
la plaie, y provoquent des lésions tissulaires locales dues à la
libération de toxines et d'enzymes, et peuvent également se
propager à la circulation sanguine. L'organisme humain dispose
de multiples mécanismes de défense, notamment le système
du complément, la phagocytose, les peptides antimicrobiens
(défensines) et d'autres structures du système immunitaire
inné. Des anticorps spécifiques dirigés contre les micro-
organismes peuvent également être mobilisés pour réduire le
nombre des germes pathogènes. De nombreuses études ont
montré que des numérations tissulaires élevées de micro-
organismes retardaient la cicatrisation de la plaie. La dose
infectieuse est significativement réduite chez les patients
atteints de diabète sucré, traités par des corticostéroïdes ou
des immunosuppresseurs ou présentant une irrigation sanguine
périphérique altérée. La présence de corps étrangers comme
des sutures chirurgicales réduit également le niveau infectieux.1
Des numérations bactériennes supérieures à 105par gramme
de tissu par ailleurs sain ont montré une corrélation avec une
mauvaise cicatrisation de la plaie et une réduction de la survie
des greffons cutanés.2Par ailleurs, il a été montré, chez les
rongeurs, un nombre réduit de bactéries favorisaient le processus
de cicatrisation des plaies en stimulant la production
d'hydroxyproline de collagène.3, 4
Le traitement initial d'une plaie comprend généralement son
nettoyage mécanique avec de l'eau, des solutions tampons
ou des antiseptiques pour éliminer les bactéries et les débris.5,6
Cette étape est essentielle dans la mesure où les débris
empêchent la cicatrisation de la plaie. L'administration
systémique d'antibiotiques est indiquée si des signes d'infection
sont présents, ou si les bactéries se sont disséminées dans
la circulation sanguine. Des décennies d'expérience ont montré
qu'il est souvent recommandé d'éviter l'utilisation d'antibiotiques
locaux, en raison du risque d'antibiorésistance. Des problèmes
significatifs sont aujourd'hui rencontrés avec un certain nombre
de germes pathogènes présents dans les plaies et
multirésistants aux antibiotiques, notamment Staphylococcus
aureus, Enterococcus spp., Pseudomonas aeruginosa, mais
également les staphylocoques coagulase négatifs et les
streptocoques.7-9 Outre la limitation de l'utilisation des
antibiotiques aux situations pour lesquelles ils sont clairement
indiqués, il existe le besoin d'un procédé nouveau et efficace
pour traiter les infections de plaies. Le principe d'hydrophobie
offre une approche alternative intéressante au traitement des
plaies infectées.
Le principe d'hydrophobie et hydrophobicité
bactérienne
Les lois de la nature imposent qu'un système aura toujours
tendance à évoluer vers l'état énergétique le plus bas possible.
Lorsque deux molécules ayant la capacité de repousser l'eau
(hydrophobes) se rencontrent, les molécules d’eau
environnantes les forcent à former l'une avec l'autre des liaisons
hydrogène. Bien qu'il n'existe aucune force d'attraction entre
les molécules hydrophobes elles-mêmes, elles s'associent par
un processus dénommé interaction hydrophobe. Les molécules
d'eau expulsées entourent les molécules hydrophobes comme
un revêtement, et les maintiennent ensemble (Figure 1).10
De nombreuses études ont montré que les bactéries,
notamment Staphylococcus aureus et les streptocoques du
groupe A - des germes pathogènes fréquemment présents
dans les plaies - et la levure Candida albicans, exprimaient
généralement une importante hydrophobicité à leur surface
cellulaire.11-14 Cette propriété est d'une importance essentielle
pour les micro-organismes dans la mesure où, par exemple,
elle leur permet de se lier aux surfaces des substrats nutritifs.
Plusieurs structures rendant la surface cellulaire hydrophobe
ont été identifiées, notamment les appendices protéiques
piliformes, les fimbriae, d'Escherichia coli qui assurent l'adhésion
à la paroi intestinale.15,16 D'autres structures hydrophobes sont
constituées par l'acide lipoteichoïque de la paroi cellulaire des
bactéries Gram positif13 et les protéines de C. albicans qui ont
été désignées par le terme « hydrophobines ».17
Hydrophobicité de la surface cellulaire comme
trait caractéristique de la virulence
La phase initiale des infections de la peau et des muqueuses
est caractérisée par l'adhésion microbienne aux tissus
traumatisés, assurée par les interactions hydrophobes entre
les microbes et les structures tissulaires de l’hôte ou par des
interactions de charges électriques. Une méthode simple pour
déterminer l'hydrophobicité de la surface cellulaire est le test
d'agrégation au sel.18,19 L'utilisation de ce test a permis de
montrer que les conditions de croissance influençaient
l'expression de l'hydrophobicité de la surface cellulaire : des
conditions de culture reproduisant une plaie, c'est-à-dire en
présence de sérum et en incubation dans une atmosphère à
5% de CO2, ont favorisé l'expression de l'hydrophobicité de la
surface cellulaire de Staphylococcus aureus, des staphylocoques
A. Ljungh
T. Wadström
A. Ljungh, T. Wadström
Service de microbiologie médicale, Université de Lund, Suède
Un nouveau pansement antibactérien sans agent
pharmacologique actif pour le soin des plaies infectées

9MEDIZIN & PRAXIS «INFECTED WOUNDS»
à coagulase négative, d'Escherichia coli, d'Enterobacter cloacae,
de Pseudomonas aeruginosa, de Candida albicans et de
plusieurs autres espèces bactériennes (Tableau 1).21 Des
milieux pauvres en nutriments simulant une situation de
carence pour les bactéries au niveau de la peau favorisent
l'expression dans différents micro-organismes de molécules
qui assurent la médiation de la liaison des protéines de la
matrice extracellulaire.22, 23
La méthode Sorbact®
Les pansements Cutisorb®Sorbact®reposent sur les propriétés
hydrophobes des germes pathogènes. Ils sont constitués
d’une trame acétate ou coton recouverte d'un ester gras
(produit par imprégnation avec du chlorure de diacylcarbamoyle
(DACC)) qui confère au matériau de fortes propriétés
hydrophobes. Dans l'environnement humide d'une plaie
exsudative, les micro-organismes adhèrent aux fibres du
pansement par interaction hydrophobe et sont éliminés de
la plaie lorsque le pansement est changé. Au cours du
traitement, Cutisorb®Sorbact®réduit la quantité de micro-
organismes et crée les conditions pour la mise en œuvre d'un
processus naturel de cicatrisation.
A. Ljungh
T. Wadström
Principe de l’hydrophobicité
Figure 1
Deux molécules hydrophobes, A et B, entrent en contact et se lient l'une à l'autre par une interaction hydrophobe, entraînant l'expulsion des molécules d'eau
(adapté de10).
Figure 2
Photographie au microscope électronique de micro-organismes se liant à
Cutisorb®Sorbact®, grossissement × 2 000 : Staphylococcus aureus (jaune),
Enterococcus faecalis (bleu), Pseudomonas aeruginosa (rose), Klebsiella spp.
(vert), et Candida albicans (orange).
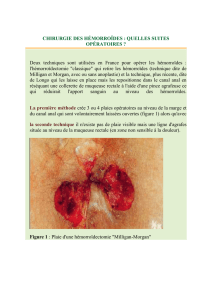
Figure 3
Staphylococcus aureus (jaune), Pseudomonas aeruginosa (rose) et Klebsiella
spp. (vert) adhérant à la surface hydrophobe des fibres de Cutisorb®Sorbact®
(grossissement × 15 000).

10 MEDIZIN & PRAXIS «INFECTED WOUNDS»
L'efficacité de cette approche a été démontrée dans plusieurs
études. Ce pansement hydrophobe a favorisé la cicatrisation
des plaies chez des porcs infectés par Staphylococcus aureus.24
Une étude clinique sur la prévention des infections du cordon
ombilical des nouveau-nés a montré des résultats comparables
à ceux obtenus avec une désinfection par une solution
d'éthanol/chlorhexidine.25 La cicatrisation des plaies chez des
patients présentant des infections de plaies provoquées par
différents micro-organismes ainsi que la prise des greffons
cutanés ont également été améliorées.26-28 L’utilisation de
Cutisorb®Sorbact®a réduit le nombre de micro-organismes
infectieux à des niveaux inférieurs à ceux altérant ou empêchant
le processus de cicatrisation. Il n'élimine pas toutes les bactéries,
mais cela s'avère en définitive bénéfique, car il a été montré
qu’un faible nombre de micro-organismes stimulait la
cicatrisation des plaies.3
Ces résultats indiquent que Cutisorb®Sorbact®peut constituer
une alternative à l'utilisation des antibiotiques et des
antiseptiques topiques, et par conséquent qu’il a la capacité
de réduire le développemnt de micro-organismes
antibiorésistants.
Références :
01. Wadström T, Ljungh Å (1995) Pathogenesis of wound infections.
In: Altmeyer P (ed.) Wound healing and infections. Springer Verlag,
Stuttgart
02. Raahave D (1990) Wound contamination correlates with postsurgical
infection rates: a new assessment technique. In: Wadström T et
al (eds) Pathogenesis of wound and biomaterialassociated infections.
Springer Verlag, London, 525-532
03. Laato M, Niinikoski J, Gerdin B (1990) The effect of Staphylococcus
aurues bacteria and its products on wound healing. In: Wasdström
T et al (eds) Pathogenesis of wound and biomaterial- associated
infections. Springer Verlag, London, 25-35
04. Levenson SM, Kan.Gruber D, Gruber C, Molnar J, Seifter E (1983)
Wound healing accelerated by Staphylococcus aureus. Archives
Surgery, 118, 310-320
05. Nichols RL (2001) Preventing surgical site infections: A surgeons
perspective. Emerg Infect Dis, 7/220-224
06. Larson E (2001) Hygiene of the skin: When is clean too clean?
Emerg Infect Dis, 7, 225-230
07. Chambers HF (1997)Methicillin resistance in staphylococci:
Molecular and biochemical basis and clinical implications. Clin
Microbiol Rev, 10(4), 781-791
08. Sieradzki K, Villari P, Tomasz A (1998) Decreased susceptibilities
to teicoplann and vancomycin among coagulase-negative methi-
cillin-resistant clinical isolates of staphylococci. Antimicrob Ag
Chemother, 42, 100-107
09. Tenover FC, Biddle JW, Lancaster MV (2001) Increasing resistance
to vancomycin and other glycopeptides in Stahylococcus aureus.
Emerg Infect Dis, 7, 327-331
10. Hjertén S, Wadström T (1990) What types of bonds are responsible
for the adhesion of bacteria and viruses to native and artificial
surfaces? In: Wadström T et al (eds) Pathogenesis of wound and
biomaterial-associated infections. Springer Verlag, London, 245-
253
11. Ljungh Å, Hjertén S, Wadström T (1985) High surface hydrophobicity
of autoaggregating Staphylococcus aureus strains isolated from
human infections studied with the salt aggregation test, SAT. Infect
Immun, 47, 522-526
12. Ljungh Å, Österlind M, Wadström T (1986) Cell surface hydrophobicity
of group D and viridans streptococci isolated from patients with
septicaemia. ZBl Bakteriol Mikrobiol Hyg, A261, 280-286
13. Doyle RJ, Rosenberg M (eds) (1990) Microbial cell surface
hydrophobicity. ASM, Washington DC
14. Hazen KC, Hazen BW (1993) Surface hydrophobic and hydrophilic
protein alterations in Candida albicans. FEMS Microbiol Lett. 1993,
107(1), 83-87
15. Faris A, Wadström T, Freer JH (1981) Hydrophobic adsorptive
hemagglutinating properties of Escherichia coli possessing colonization
factor antigens (CFA/I or CFA/II), type 1 pili, or other pili. Current
Microbiol, 5, 67-72
16. Ljungh Å, Wadström T (1983) Fimbriation of Escherichia coli in
urinary tract infections. Comparisons between bacteria in the urine
and subcultured bacterial isolates. Current Microbiol 8, 263-268
17. Wessels JGH (1997) Hydrophobins: proteins that change the nature
of a fungal surface. Adv Microb Physiol., 38, 1-45
18. Lindahl M, Faris A, Wadström T, Hjertén S (1981) A new test based
on „salting out“ to measure relative surface hydrophobicity of
bacterial cells. Biochim Biophys Acta, 677, 471-476
A. Ljungh
T. Wadström
Tableau 1
Influence des conditions de croissance sur l'expression de l'hydrophobicité de la surface cellulaire de trois
bactéries typiques des plaies mesurée par le test d'agrégation au sel (d'après21)
Conditions de croissance Hydrophobicité de la surface cellulaire (test d'agrégation au sel)
Staphylococcus Escherichia Pseudomonas
aureus coli aeruginosa
Sang, O2 > 2 > 2 > 2
Sang, CO2 à 5 % 22> 2
Sang + sérum, CO2 à 5 % 1 0,5 1
Hématine, O2 > 2 2 > 2
Hématine, CO2 à 5 % 222
Hématine + sérum, CO2 à 5 % 0,5 0,25 1
Une faible valeur du test d’agrégation au sel correspond à une forte hydrophobicité de la surface cellulaire.
L'expression de l'hydrophobicité de la surface cellulaire augmente en présence de sérum dans le milieu de croissance et
sous atmosphère de CO2, ce qui est indiqué par les valeurs plus faibles obtenues au test d'agrégation au sel.

11MEDIZIN & PRAXIS «INFECTED WOUNDS»
19. Rozgonyi F, Szitha KR, Ljungh Å, Baloda SB, Hjertén S, Wadström T
(1985) Improvement of the salt aggregation test to study bacterial
cell surface hydrophobicity. FEMS Microbiol Lett. 30, 131-138.
20. Jonsson P, Wadström T (1984) Cell surface hydrophobicity of
Staphy-lococcus aureus measured by the salt aggregation test
(SAT). Current Microbiol, 10, 203-210
21. Ljungh Å, Wadström T (1995) Growth conditions influence expression
of cell surface hydrophobicity of staphylococci and other wound
infection pathoens. Microbiol Immunol, 39 (10), 753-757
22. Liang OD, Ascencio F, Vazquez-Juarez R, Wadström T (1993)
Binding of collagen, fibronectin, lactoferrin, laminin, vitronectin
and heparan sulfate to Staphylococcus aureus strain V8 at various
growth phases and under nutrient stress conditions. Zentralbl.
Bakteriol., 279(2), 180-190
23. Kjelleberg S (ed) (1993) Starvation in bacteria. Plenum Press,
New York
24. Wadström T, Björnberg S, Hjertén S (1985) Hydrophobized wound
dressing in the treatment of experimental Staphylococcus aureus
infections in the young pig. Acta path. microbiol. Immunol. Scand.
(B), 93, 359-363
25. Meberg A, Schoyen R (1990) Hydrophobic material in routine
umbilical cord care and prevention of infection in newborn infants.
Scand. J. Infect. Dis., 22(6), 729-733
26. Lunnergård J, Larsson S, Andersson K, Ljungh Å (1990) Evaluation
of wound healing by quantifying of bacteria and computerized
image analysis – a pilot study in primary health care. In: Wadström
T et al. (eds) Pathogenesis of wound and biomaterial-associated
infections. Springer Verlag, London, 169-173
27. Friman G (1990) Bacterial affinity for hydrophobic ligands can be
employed in the treatment of infected wounds in patients. In:
Wadström T et al. (eds) Pathogenesis of wound and biomaterial-
associated infections. Springer Verlag, London, 173- 179
28. Wadström T, Ljungh Å, Jonsson C-E, Hjertén S (1986) Treatment
with hydrophobized dressings hastens healing of infected wounds.
J Sw Med Assoc, 83, 2548-2550
A. Ljungh
T. Wadström
Auteurs :
Professeur Asa Ljungh
Professeur Torkel Wadström
Département de microbiologie médicale
Université de Lund
S-22362 Lund
Suède
 6
6
1
/
6
100%