Nous aborderons dans ce cours la mise en place de la face

Nous aborderons dans ce cours la mise en place de la face et le développement
de la cavité buccale notamment du palais.
Les objectifs sont les suivants:
‐
d
éc
rire
la
mise
en
place
des
bourgeons
cr
ân
iofaciaux
et
leur
devenir
d
éc
rire
la
mise
en
place
des
bourgeons
cr
ân
iofaciaux
et
leur
devenir
‐identifier les structures concernées sur des schémas et être capable de
redessiner les grandes étapes de ce développement
‐replacer l’origine embryologique de ces structures
‐connaître la chronologie des évènements.
Les
aspects
mol
éc
ulaires
li
és
à
la
mise
en
place
de
ces
élément
s
et
leur
devenir
Les
aspects
mol
éc
ulaires
li
és
à
la
mise
en
place
de
ces
élément
s
,
et
leur
devenir
seront évoqués.
1

1. Introduction
La mise en place de la face et de la cavité buccale s’effectue entre la quatrième
et la dixième semaine du développement chez l’homme et est indissociable
de la formation des arcs pharyngés et de leur colonisation par les cellules
issues des crêtes neurales céphaliques.
1.1.L’évolutiondudéveloppementembryonnairechez la souris génétiquement
modifiée présentée sur ces images illustre bien les profonds remaniements
nécessaires à la formation du massif crâniofacial. L’âge de l’embryon est
donnéennombredesomitesetensuiteenjourE(laduréedegestationchez
la souris est d’environ 19
j
ours
)
. Ces souris trans
g
éni
q
ues
p
ossèdent un
j)
gq
p
élément de réponse à l’acide rétinoïque lié au lacZ qui permet un crible de
sélection par la coloration bleue (soit ici la construction RARElacZ).
La coloration bleue marque ainsi les zones où l’activité acide rétinoïque est
effective (objectivée par la production d’acide rétinoïque le métabolite actif
de la vitamine A ou rétinol).
Regardez
ainsi
au
jour
embryonnaire
E
9
5
le
massif
crâniofacial
signalé
par
une
Regardez
ainsi
au
jour
embryonnaire
E
9
.
5
le
massif
crâniofacial
signalé
par
une
flèche.
L'acide rétinoïque est une molécule indispensable au développement, elle peut
aussi se révéler un puissant tératogène (c’est à dire une substance ou un
procédé qui provoque des malformations chez l’embryon ou le foetus quand
la mère est exposée) affectant en particulier le développement de la face et
d
li
2
d
upa
l
a
i
s.

1.2. Coupes frontales de souris E10.5 Foxg1‐Cre;ROSA26R
Sur ces coupes frontales de souris génétiquement modifiées (par une
construction différente nommée Foxg1‐Cre;ROSA26R) au jour E10.5 du
développement embryonnaire, la coloration bleutée (à la béta‐galactosidase) est
un marqueur, entre autre, des dérivés des crêtes neurales et se retrouve tout
autour de la cavité buccale (voir flèche) en particulier dans les arcs pharyngés.
3

2.Miseenplacedelaface
2.1.Lasemaine4
Tout commence à la quatrième semaine du développement.
‐
L
’
embryon
mesure
entre
2
(d
éb
ut)
et
5
(fin)
millim
èt
res
Les
r
ég
ions
cr
ân
iales
et
Lembryon
mesure
entre
2
(d
éb
ut)
et
5
(fin)
millim
èt
res
.
Les
r
ég
ions
cr
ân
iales
et
cervicales (cou) constituent environ la moitié de la longueur de l’embryon.
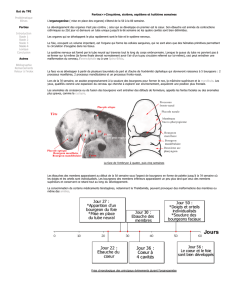
‐Au début de la 4ème semaine, l’embryon est encore rectiligne. Les somites
forment des saillies nettement visibles à sa surface (le 1er somite est apparu au
20ème jour). Leur nombre sert à exprimer l’âge de l’embryon jusqu’à la fin de la
4ème semaine qui correspond au stade de développement 28 somites. Le tube
neural
est
ferm
é
en
regard
des
somites
mais
est
ouvert
au
niveau
des
neural
est
ferm
é
en
regard
des
somites
mais
est
ouvert
au
niveau
des
neuropores.
‐Les plis limitant céphalique et caudal apparaissent respectivement au 22ème
et au 23ème jours.
‐Au 24ème jour, le neuropore crânial se ferme. A ce moment les 2 premiers arcs
branchiaux sont visibles. Le cœur constitue une volumineuse saillie sous
l’embryon.
‐Au jour 26, le neuropore postérieur se ferme. Trois arcs branchiaux sont
visibles. Il y a apparition au niveau de l’encéphale, des courbures
mésencéphalique et cervicale. L’ébauche du membre supérieur apparaît, les
fossettes auditives (dépression otique) sont visibles.
‐A
u
jou
r2
8
,
quat
r
e
pa
ir
es
d
’
a
r
cs
p
h
a
r
y
n
gés
so
n
t
vi
s
i
b
l
es
a
in
s
i
que
l
es
bou
r
geo
n
s
4
u
jou
8
,
quat e
pa es
da cs
paygés
so t
sbes
as
que
es
bou geo s
des membres inférieurs et les placodes ectoblastiques cristalliniennes à l’origine
du cristallin (développement de l’œil). La paroi ventrale est pratiquement
achevée.

2.2. Les semaines 4/5
La face en développement est représentée par la région frontonasale (en vert) et
le premier arc pharyngé (en orangé) scindé en bourgeons maxillaires et
mandibulaires. Elle est mise en place au cours du deuxième mois par le
développement et la fusion de 5 bourgeons : le bourgeon frontal ou frontonasal
(en vert), les deux bourgeons maxillaires, les deux bourgeons mandibulaires.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%