la medecine nucleaire - Association I

LA MEDECINE NUCLEAIRE
A) Généralités
Définition
C’est la discipline qui regroupe les utilisations médicales des substances radioactives (ou
radionucléides) présentées en sources non scellées, c’est-à-dire sous des formes susceptibles
de dispersion : sous la forme liquide ou la forme gazeuse.
Le principe repose sur le fait d’utiliser des radionucléides (la plupart du temps d’origine
artificielle) qui sont chimiquement identiques aux éléments naturels ou bien des molécules
(médicaments, anticorps) rendues radioactives en leur liant un radionucléide (on parlera alors
de marquage).
On distingue :
- la Médecine Nucléaire « in Vitro » où l’on ajoute en laboratoire des radionucléides à des
échantillons biologiques pour permettre de dosage de substances à de très faibles concentrations
(dosages d’hormones thyroïdiennes et hypophysaires, dosages de marqueurs tumoraux) on
nomme aussi cette discipline la RadioImmunoAnalyse (RIA). Actuellement, le marqueur
radioactif le plus utilisé en immuno-analyse est l'Iode 125. En effet, ses caractéristiques
physiques de période (60 jours) et de rayonnement (gamma de 35 keV) en font l'isotope de
choix : une durée de 4 à 8 semaines selon la vitesse de radiolyse du traceur (c'est-à-dire la
rupture de la liaison entre l'anticorps ou l'antigène et l'Iode 125), un rayonnement gamma
détectable dans des compteurs à scintillation, mais d'énergie faible pour éviter une irradiation
externe du personnel (l’activité manipulée étant très réduite).
- la Médecine Nucléaire « in Vivo » où l’on administre directement le radiopharmaceutique à
l’homme par voie veineuse (le plus souvent).
La médecine nucléaire « in vivo » regroupe deux utilisations majeures :
• L’étude diagnostique = la scintigraphie
• Le but thérapeutique = la radiothérapie
C’est une discipline jeune qui se développe depuis une trentaine d’année et en pleine
expansion actuellement, malgré un retard considérable par rapport aux autres pays européens :
le taux d’équipement en France n’est que de 6 gamma-caméras par million d’habitants alors
qu’il est de 23 caméras en Belgique.
Compte tenu de la grande possibilité de contamination, le service de médecine nucléaire est
soumis à des autorisations particulières pour utiliser ces sources et doit disposer de moyens
spécifiques de radioprotection afin de protéger le personnel et le public.

B) La SCINTIGRAPHIE
1) Définition
La scintigraphie est une technique d’imagerie par introduction de produit radioactif dans
l’organisme.
Elle permet d’étudier la forme, la situation, la taille d’un organe, et surtout d’y localiser une
éventuelle zone anormale ayant augmenté ou diminué sa capacité d’y fixer le vecteur injecté.
Les résultats y sont alors visualisés sous forme d’images.
Elle permet également d’apprécier la valeur fonctionnelle de l’organe (cinétiques de fixation
ou d’élimination obtenus sous forme de courbes ou de pourcentages).
Elle sert donc pour le diagnostic puisqu’on obtient donc une image physiologique qui traduit
le fonctionnement de l’organe, du tissu ou des cellules, c’est à dire leur métabolisme sans les
perturber.
2) Bases d’imagerie : comparaison entre la radiologie et la scintigraphie
L’objectif de tout système d’imagerie est d’obtenir, à partir d’un objet tridimensionnel, une
image, généralement plane qui soit un reflet aussi fidèle que possible de l’objet.Une telle
opération nécessite l’intervention d’un agent physique (ici, les ondes électromagnétiques X ou
γ) qui effectue le transfert d’information entre l’objet et l’image. Le but est d’obtenir
l’information désirée en irradiant le moins possible le patient.
a) technique par transmission
C’est typiquement le fait de l’imagerie radiologique qu’elle soit en projection (radiologie
conventionnelle) ou qu’elle soit tomographique (tomodensitométrie ou scanner), le tube à
rayons X est placé d’un côté du patient et le recueil des rayons transmis s’effectue de l’autre
côté, que ce soit au moyen d’un écran fluorescent (scopie), d’un film radiologique
(radiographie), ou au moyen d’un détecteur de rayonnement (radiologie numérisée ou
scanner). On étudie donc l’atténuation du rayonnement par les différentes structures de la
partie à étudier du patient: on obtient une image anatomique.
source
radiogène
« objet »
image de projection plane d’un
volume
Principe de la radiologie

b) technique par émission
Elle repose sur l’enregistrement des signaux émis par les organes à imager.
La scintigraphie utilise l’émission à partir d’une substance radioactive introduite dans
l’organisme (en quantité infime) généralement couplée à une molécule qui présente une
affinité pour un organe particulier. La détection des rayonnements γ émis par la molécule est
réalisée par voie externe grâce à un appareillage particulièrement sensible: la gamma-caméra.
Principe de la scintigraphie Gamma caméra => image de projection
plane d’un volume
« objet »
+ source
radioactive
On utilise pour cela des produits radioactifs qui ont une affinité pour l’organe à étudier ou les
combiner avec une molécule pharmaceutique qui, elle, possède cette affinité. Lorsque le
radiopharmaceutique est capté de façon plus importante par un certain type de tissu par
rapport à la normale, on parlera d’hyperfixation. On parlera d’hypofixation dans le cas
contraire.
3) Caractéristiques communes à toutes les scintigraphies
- innocuité complète
- examen atraumatique
- irradiation le plus souvent inférieure ou identique à celle délivrée par une radio ou un
examen tomodensitomètrique du même organe
- parfaitement réalisable en pédiatrie
- extrême rareté et le plus souvent bénignité des réactions allergiques, même chez les sujets
polyallergiques
- pas d’hospitalisation pour ce type d’exploration
- pas de nécessité d’être à jeun (dans la très grande majorité des cas)

- seules deux contre-indications :
- la grossesse. Le prescripteur s’assure théoriquement de l’absence de grossesse chez sa
patiente et il fera réaliser la scintigraphie dans les dix premiers jours qui suivent la
date des règles. Il est cependant évident indispensable que la personne administrant le
radiotraceur s’assure de l’absence de cette contre-indication. L’exception est pour
l’urgence vitale : la femme enceinte chez qui on soupconne une embolie pulmonaire.
On fera alors la scintigraphie de perfusion seule et en prenant soin de n’injecter que le
tiers de l’activité normale.
- l’allaitement (C.I relative). Il suffit de l’interrompre 48 heures à la suite d’une
scintigraphie avec un traceur technetié, d’augmenter la diurèse avec des boissons
abondantes et d’éliminer le lait deux à trois fois par jour avec un tire-lait. Pour les
autres traceurs à période plus longue, il faut interroger le médecin isotopiste.
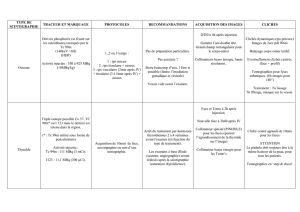
4) Les différents types de scintigraphies
On réalise dans la plupart des services de médecine nucléaire les scintigraphies suivantes :
- la scintigraphie osseuse (tumeurs bénignes ou malignes, rhumatologie, traumatologie,
infections…) (avec l’HMDP - 99m Tc)
- les scintigraphies pulmonaires:
- de perfusion (injection IV de particules embolisantes à base d’albumine humaine)
- de ventilation (à l’aide de gaz radioactifs ou de fines particules en suspension dans
l’air)
- les scintigraphies cardiaques :
- étude de la perfusion myocardique (au 201 thallium ou au MIBI- 99m Tc))
- ventriculographie isotopique (calcul de la Fraction d’Ejection Ventriculaire Gauche)
- la scintigraphie thyroïdienne (à l’123 Iode ou au 99m Tc seul)
- la scintigraphie de perfusion cérébrale (HMPAO - 99m Tc)
- les scintigraphies rénales (dynamiques ou statiques) (DMSA - 99m Tc OU DTPA- 99m Tc))
- la scintigraphie au 67 Gallium permet l’étude des infections car il se fixe sur les tissus
inflammatoires mais se fixe aussi sur la sarcoïdose et un certain nombre de tumeurs
(Ostéite, Ostéomyélite chez le jeune enfant, spondylodiscite).
- la scintigraphie à l’octréotide marqué à l’111Indium permet d’étudier la présence d’un
certain nombre de tumeurs portant des récepteurs à la somatostatine (tumeurs neuro-
endocriniennes)

C) Les RADIO-PHARMACEUTIQUES
1) Définition
Substance ou composition contenant un radio-nucléide pouvant être administrés à l’homme
dans un but diagnostique ou thérapeutique. Il nécessite une AMM (Autorisation de Mise sur le
Marché).
Certains traceurs tels que l’123 I ou le 201Tl ont des affinités naturelles pour certains organes
(thyroïde, myocarde, etc). Mais ce n’est pas une propriété courante ; il faut donc utiliser des
médicaments qui ont un tropisme connu pour un organe spécifique en leur associant un
radionucléide (généralement le 99mTc): c’est le principe du marquage.
Le radio-isotope est appelé le marqueur, la molécule qui va l’emmener est appelée le vecteur.
L’ensemble forme le traceur radioactif ou radiotraceur ou radiopharmaceutique.
vecteur
vecteur
Traceur ou radiopharmaceutique
radioactif froid
marqueur
marquage
2) Production de radionucléides
Dans leur grande majorité, les radio-nucléides sont produits artificiellement.
Ces radio-nucléides sont générés en soumettant les isotopes stables au bombardement de
particules d’énergie élevée soit dans des accélérateurs soit dans des réacteurs nucléaires ;
certains radio-nucléides se forment dans le combustible des réacteurs nucléaires par réaction
de fission de l’235 U.
1) Radionucléides directement livrés par les industriels
Les radionucléides suivants arrivent sous forme liquide et sont directement injectables: 201 Tl,
123 I, 111 In, 67 Ga, 18 F
Ils peuvent être obtenus de deux manières:
- soit par fission
- soit par bombardement d’une cible d’un élément de Z proche avec des particules lourdes
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%