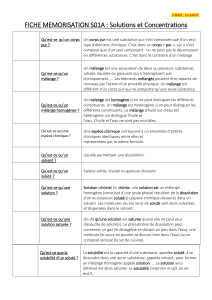
Phénomènes de transport à travers les membranes biologiques

1
Phénomènes de Transport à travers
les membranes biologiques
1. La Diffusion Libre
1.1 Introduction
1.1.1 Transport de chaleur
1.1.2 Transport de molécules à l’état gazeux
1.2 Diffusion de masse dans les solutions : Transport de soluté
1.2.1 Définitions
1.2.2 Régime transitoire
1.2.3 Régime permanent
1.3
Flux et densité de flux
1.4 Première loi de Fick
1.5 Loi de Fick généralisée
1.5.1 En milieu homogène
1.5.2 En milieu non homogène
2. Diffusion à travers les membranes
2
Phénomènes de transport à travers
les membranes biologiques
1. Diffusion libre : approche macroscopique Lois de Fick
• définition : la diffusion correspond à un phénomène de
transport d’une grandeur physique.
1.1 Introduction
1.1.1 Transport de chaleur
Considérons une barre métallique isolée thermiquement de
l’extérieur :
Si T
A
et T
B
sont maintenues ctes ⇒
état d’équilibre
La température au point M d’abscisse x sera donnée par la
relation :
x
L
T
T
T)x(T
A
B
A
⋅
−
+=
Il existe alors, au point M, un gradient de température :
→
→
→
→
⋅
−
=⋅=⋅
∂
∂
=i
L
TT
i
xd
Td
i
x
T
Tgrad A
B
avec :
A
B
A
BTTsi
L
T
T
<<
−
0
A
B
M
T
A
T
B
x
x
L
i

3
• Il s’agit d’un équilibre dynamique car il s’accompagne d’un
flux de chaleur permanent de A vers B
• Ce flux de chaleur est caractérisé par son intensité :
dt
dQ
• Si T
A
→ T ’
A
et T
B
→ T ’
B
alors la T° de la barre évolue
vers un autre état d’équilibre dynamique, par
l’intermédiaire d’un régime transitoire.
1.1.2 Transport de molécules à l’état gazeux
Considérons une enceinte fermée contenant un gaz
Les molécules de gaz sont
en état d’équilibre dynamique
C’est le phénomène
d’agitation thermique
T
A
T
B
T
O
x
L
4
• Diffusion de masse : il faut qu’il y ait un mouvement
d’ensemble des molécules.
Pour créer cette diffusion, il suffit d’ouvrir un orifice de
l’enceinte :
Au bout d’un temps très long : concentration uniforme de
gaz dans l’enceinte et dans le milieu extérieur.
Pour qu’il y ait diffusion, il faut donc que la distribution
dans l’espace des molécules ne soit pas homogène
On constate aussi que :
• ce phénomène de diffusion est très lent (≈ µm/s),
• le déplacement des molécules s’effectue vers les régions
de faible concentration,
• il est toujours possible de réaliser un régime permanent
(ou stationnaire).

5
1.2 Diffusion de masse dans les solutions : Transport
de soluté
1.2.1 Définitions
• solution : mélange de composés chimiquement différents
et non réactifs.
• le composé majoritaire s’appelle le solvant (eau, sang, …)
• les composés dissous sont les solutés (ions, sucre, urée …).
On supposera toujours que les solutions sont très diluées :
Nbre de molécules de soluté << Nbre de molécules de solvant
• la concentration peut être définie de 3 manières :
1) Nombre de particules de soluté / unité de volume de
solution : concentration en molécules
dV
dN
C= ;
[
]
3
LC
−
=
2) Masse de soluté / unité de volume de solution :
concentration massique
dV
dm
C
m
=
;
[
]
3
LMC
−
⋅=
3) Nombre de moles de soluté / unité de volume de solution :
concentration molaire
dV
dn
x=
;
[
]
3
LC
−
=
ex : 1 mole de glucose (M = 180 gmol
-1
) dans 1 litre d’eau
x = 1 mole/litre = 10
3
moles/m
3
C = 6,02.10
23
molécules/litre = 6,02.10
26
molécules/m
3
C
m
= 180 g/litre = 180 kg/m
3
6
• Diffusion de molécules de soluté
⇔ déplacement macroscopique de ces molécules d'une
région de forte concentration vers une région de faible
concentration, résultant de l’agitation thermique et reposant
sur l’idée de marche au hasard.
Les molécules de solutés ont des mouvements permanents
liés à l'agitation thermique.
Solution diluée : les molécules n'interagissent entre elles
que pendant les chocs.
Entre 2 collisions, le trajet des molécules est rectiligne.
déplacements aléatoires des molécules
A
B
L
1
L
2
L
i
A l'échelle microscopique, suite de chemins irréguliers en
zig-zag
phénomène décrit par la marche au hasard et
caractérisé par :
N
L
x
N
1i i
∑
=
=∆
libre parcours moyen (= distance moyenne
parcourue par une molécules entre 2 chocs)
t
∆
intervalle de temps moyen entre 2 chocs

7
A l'échelle macroscopique, on définit une vitesse moyenne
des molécules < v > = vitesse d'ensemble
A l'équilibre dynamique : pas de mouvement d'ensemble des
molécules
A
B
A ≡ B
< v > = 0
Diffusion de masse = diffusion des molécules de solutés
A
B
A ≠ B
< v > ≠ 0
Remarques importantes
• Pour qu'il y ait diffusion, il faut que la concentration en
molécules de solutés soit inhomogène dans l'espace
• Le déplacement des molécules s'effectue vers les régions
de faibles concentrations
• Diffusion : phénomènes très lents ( < v > ≈ µm.s
-1
)
8
1.2.2
Régime transitoire
Considérons une enceinte fermée :
à t = 0, on enlève la cloison ⇒ diffusion des molécules de
soluté du compartiment le + concentré (
) vers le
compartiment le moins concentré (
).
il y a un flux de particules de soluté
à t > 0, variation de la concentration : C = C(x,t).
Taux de variation de C = gradient de concentration
→
→
∂
∂
=i
x
C
C
grad
(diffusion unidirectionnelle)
C
1
L/2
L
0
C(x,t)
x
t = 0
t > 0 fixé
C
2
grad C
FLUX
Le flux s'oppose au gradient de concentration
0
x
C
<
∂
∂
Compartiment
C
1
Compartiment
C
2
cloison
O
M
L
x

9
à t = ∞, nouvel état d’équilibre : C = C
∞
=
2
C
C
21
+
uniforme
dans l’enceinte ⇒
0
x
C
=
∂
∂
0
L
C(x,t)
x
t =
∞
C
∞
1.2.3
Régime permanent
Il est possible de créer un régime permanent ou stationnaire
le gradient de concentration doit être maintenu différent
de zéro
0
t
C
maist0
x
C
=
∂
∂
∀≠
∂
∂
C = C(x) indépendant de t
Rq : La concentration moyenne
C
est
∫
⋅=
L
0
dx)x(C
L
1
C
1.3 Flux et densité de flux de soluté
Nous considérerons dans la suite une diffusion
unidirectionnelle, dans le sens des x par exemple.
10
• Flux de soluté J(x,t)
C’est le nombre de particules de soluté traversant un plan
d’abscisse x donné, par unité de temps
x
O
L
S
x
sens > 0 de propagation
x
C
∂
∂
J
Si dN est le nbre de particules de soluté ayant traversé S
pendant dt, alors :
dt
dN
)t,x(J =
[J] = T
-1
unité S.I. : s
-1
• Densité de flux de soluté j(x,t)
La densité de flux est égale au nombre de molécules de
soluté qui traversent l’unité de surface par unité de temps
⇔ la densité de flux est le flux par unité de surface
traversée.
Si S est l’aire de la section transversale de l’enceinte, alors :
dt
dN
S
1
)t,x(j =
⇔
)t,x(J
S
1
)t,x(j =
[j] = L
-2
T
-1
unité S.I. : m
-2
s
-1
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%