Devoir Corrigé: Formules des Composés Ioniques (3ème)

Physique 3ème
1
Classe : 3A/B
Physique
DM 04
Correction
Ecriture des formules
Les composés ioniques ne contiennent pas de molécules distinctes mais des ions en interaction
électrostatique.
Un composé ionique est formé par l’association d’ions positifs et négatifs.
Un composé ionique est électriquement neutre.
Exemples :
- On écrit l’ion positif en premier et l’ion négatif en second. (C’est l’inverse de ce qu’on entend !)
- Les charges (+ et -) n’apparaissent pas dans la formule ;
- Les nombres placés en indice en bas à droite correspondent à la quantité relative de chaque ion
pour assurer la neutralité électrique.
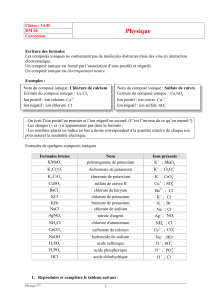
Formules de quelques composés ioniques
Formules brutes
Nom
Ions présents
4
KMnO
permanganate de potassium
K
;
4
MnO
2 2 7
K Cr O
dichromate de potassium
K
;
2
27
Cr O
24
K CrO
chromate de potassium
K
;
2
4
CrO
4
CuSO
sulfate de cuivre II
2
Cu
;
2
4
SO
2
BaCl
chlorure de baryum
2
Ba
;
Cl
KCl
chlorure de potassium
K
;
Cl
KBr
bromure de potassium
K
;
Br
NaCl
chlorure de sodium
Na
;
Cl
3
AgNO
nitrate d'argent
Ag
;
3
NO
4
NH Cl
chlorure d'ammonium
4
NH
;
Cl
3
CaCO
carbonate de calcium
2
Ca
;
2
3
CO
NaOH
hydroxyde de sodium
Na
;
HO
24
H SO
acide sulfurique
H
;
2
4
SO
34
H PO
acide phosphorique
H
;
3
4
PO
HCl
acide chlorhydrique
H
;
Cl
1. Reproduire et compléter le tableau suivant :
Nom du composé ionique: Chlorure de calcium
Ecriture du composé ionique :
Ion positif : ion calcium
Ion négatif : ion chlorure
Nom du composé ionique : Sulfate de cuivre
Ecriture du composé ionique :
Ion positif : ion cuivre
Ion négatif : ion sulfate

Physique 3ème
2
On écrira :
- la formule des ions positifs (1ère ligne)
- la formule des ions négatifs (2ème ligne)
- le nom des composés ioniques
- la formule des composés ioniques
L'hydroxyde est l'anion HO- ; il est anciennement noté OH-, mais la première écriture permet de
mettre en évidence le fait que la charge négative est portée par l'oxygène.
Ion positif
Ion négatif
Ion cuivre II
2
Cu
Ion Fer II
2
Fe
Ion Fer III
3
Fe
Ion Sodium
Na
Ion magnésium
2
Ca
Ion chlorure
Cl
Chlorure de
cuivre II
2
Cu Cl
Chlorure de
fer II
2
FeCl
Chlorure de
fer III
3
FeCl
Chlorure de
sodium
NaCl
Chlorure de
magnésium
2
MgCl
Ion Hydroxyde
HO
Hydroxyde
de cuivre II
2
Cu (OH)
Hydroxyde
de fer II
2
Fe (OH)
Hydroxyde
de fer III
3
Fe (OH)
Hydroxyde
de sodium
Na OH
Hydroxyde de
magnésium
2
Mg (OH)
Ion sulfate
2
4
SO
Sulfate
de cuivre II
4
Cu SO
Sulfate
de fer II
4
FeSO
Sulfate
de fer III
2 4 3
Fe (SO )
Sulfate
de sodium
24
Na SO
Sulfate
de magnésium
4
Mg SO
Ion carbonate
2
3
CO
Carbonate
de cuivre II
3
Cu CO
Carbonate
de fer II
3
FeCO
Carbonate
de fer III
23
3
Fe CO
Carbonate
de sodium
23
Na CO
Carbonate
de magnésium
3
Mg CO
2. Chercher des utilisations des composés suivants :
- le chlorure de sodium : c’est le sel de table, utilisé pour conserver les aliments et le
salage des routes en hiver.
http://fr.wikipedia.org/wiki/Chlorure_de_sodium
- l’hydroxyde de sodium : c’est la soude utilisée dans la fabrication des savons, pâte à
papier, les lessives, déboucheurs chimiques.
http://fr.wikipedia.org/wiki/Soude
- le carbonate de sodium : il est utilisé pour la fabrication des détergents et lessives.
http://fr.wikipedia.org/wiki/Carbonate_de_sodium
- Le carbonate de magnésium : est utilisé comme anti-transpirant dans de nombreux
sports, connu sous le nom de magnésie. (Ex : saut à la perche, haltérophilie, gymnastique)
http://fr.wikipedia.org/wiki/Carbonate_de_magn%C3%A9sium
3. Ecrire la formule chimique :
- du chlorure de calcium
- de l’hydrogénocarbonate de sodium
Vous préciserez les ions positifs et négatifs.
Formule
Nom
Ions en présence
2
CaCl
chlorure de calcium
2
Ca
;
Cl
3
NaHCO
hydrogénocarbonate de sodium
Na
;
3
HCO
1
/
2
100%