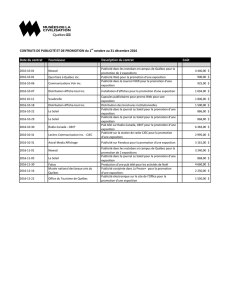
recommandations d`un forum québécois sur la

VOTRE DÉVELOPPEMENT PROFESSIONNEL CONTINU
DPC et spécialités
Algorithme de traitement de la douleur neuropathique
Recommandations
d’un forum québécois
sur la douleur neuropathique
Par Aline Boulanger, Pierre Arsenault, Alain Béland, André Bélanger, Christian Cloutier,
Dominique Dion, Pierre Dolbec, Angela Genge, David Lussier, Serge Marchand,
Huu Tram Anh Nguyen, Robert Thiffault et Mark Ware
Sont représentés au conseil de
rédaction de MedActuel DPC
Conseil de rédaction et
révision scientifique
Le Collège
québécois
des médecins
de famille
La faculté de
médecine de
l’Université
Laval
L’Association
des médecins
de langue
française
du Canada
Président du conseil
Dr François Croteau
Omnipraticien, hôpital Santa-Cabrini,
Montréal ;
Membre du Comité de formation
médicale continue de l’Association
des médecins de langue française
du Canada ;
Directeur médical aux
Éditions Santé Rogers Media.
Dre Johanne Blais
Membre du Conseil de FMC de
la faculté de médecine de l’Université
Laval ;
Responsable du Comité de FMC
du dépt. de médecine familiale
de l’Université Laval ;
Professeur adjoint de clinique,
CHUQ, hôpital Saint-François d’Assise
Dr Roger Ladouceur
Responsable du Plan d’autogestion de
DPC, Collège des médecins du Québec;
Professeur agrégé de clinique du dépt.
de médecine familiale de l’Université de
Montréal;
Médecin de famille,
Hôpital de Verdun du CSSS du Sud-
Ouest-Verdun
Dre Francine Léger
Médecin de famille ;
Chargé d’enseignement clinique
au département de médecine
familiale de l’Université de
Montréal ;
Service de périnatalité du CHUM.
Dre Diane Poirier
Médecin, M.Sc. ;
Chef du service des soins intensifs
au CSSS Richelieu-Yamaska;
Chargé d’enseignement clinique
à l’Université de Montréal;
Membre du comité de FPC
de l’AMLFC.
Objectifs pédagogiques
● Connaître la physiopathologie
et le diagnostic des douleurs
neuropathiques.
● Préciser les indications et les
précautions lors de l’instauration des
traitements pharmacologiques et non
pharmacologiques
des douleurs neuropathiques.
● Savoir prescrire et débuter
les différents traitements pour
les douleurs neuropathiques.
Mots-clés
Douleur neuropathique, algorithme de
traitement.

2
Algorithme de traitement de la douleur neuropathique
La physiopathologie
Selon la définition proposée en 2007 par le
forum sur la douleur neuropathique de l’Inter-
national Association for the Study of Pain, la
douleur neuropathique est une douleur secon-
daire à un trouble ou à une maladie affectant le
système somatosensoriel (Treede et coll.). Elle
peut être d’origine centrale, périphérique
(mononeuropathie ou polyneuropathie) ou
mixte (tableau I).
Les symptômes varient grandement d’un sujet
à l’autre. La douleur peut être spontanée, c’est-
à-dire qu’elle se manifeste d’elle-même, sans sti-
mulus, ou évoquée, soit le plus souvent provo-
quée ou exacerbée par le toucher, le frottement
ou le contact avec le froid ou le chaud (allody-
nie). La douleur spontanée est parfois continue
(sensation de brûlure, d’étau ou de compres-
sion), parfois intermittente (sensation de
décharge électrique ou de coup de couteau).
La douleur neuropathique peut également être
accompagnée d’hypoesthésies, de paresthésies
(fourmillements, picotements et démangeai-
sons) et de signes cliniques témoignant d’une
atteinte neurologique.
La neurophysiologie des douleurs
neuropathiques
La neuropathie périphérique
Les afférences nociceptives primaires sont nor-
malement activées par des stimuli potentiel-
lement dommageables pour les tissus ainsi que
par différents médiateurs neurochimiques de
l’inflammation. Cette activation est transmise
au niveau spinal aux neurones de deuxième
ordre qui transmettent le message nociceptif
aux centres supérieurs. En présence de certai-
nes affections, comme dans le cas des neuro-
pathies périphériques, l’activation nociceptive
est persistante ou répétitive, ce qui induit une
intensification progressive de la douleur, un
phénomène de sommation temporelle. Sur le
plan neurophysiologique, il s’agit d’un phéno-
mène de wind-up qui correspond à l’augmen-
tation de l’activité neuronale périphérique des
fibres C lors d’une stimulation soutenue ou
répétée. Cette amplification de la réponse péri-
phérique est normalement passagère, mais elle
peut induire une sensibilisation spinale qui
persiste même après la fin de la stimulation
périphérique. Le traitement rapide de la dou-
leur est donc impératif afin d’éviter la sensibi-
lisation centrale.
La sensibilisation centrale
La sensibilisation spinale se définit par une aug-
mentation de l’excitabilité et des décharges
spontanées des neurones des cornes postérieu-
res de la moelle, un élargissement des champs
récepteurs et une augmentation des réponses
provoquées par la stimulation des fibres de petit
calibre, normalement responsables de la trans-
mission de la douleur (hyperalgésie), et de grand
calibre, normalement responsables de la trans-
mission des sensations non douloureuses (allo-
dynie). Sur le plan neurochimique, l’activation
nociceptive spinale dépend essentiellement de
l’activation postsynaptique des récepteurs
AMPA par le glutamate, le principal neurotrans-
metteur excitateur du SNC. Toutefois, en pré-
sence d’une sensibilisation spinale, les récepteurs
NMDA seraient aussi activés par la libération
soutenue de glutamate, et les récepteurs NK1,
par la libération additionnelle de substance P.
Ces mécanismes physiologiques et neurochimi-
ques de sensibilisation spinale pourraient entraî-
ner une modification de l’organisation des cir-
cuits spinaux et contribuer au développement
ainsi qu’au maintien de la douleur chronique. Il
est important de souligner qu’une douleur per-
sistante peut aussi engendrer des sensibilisations
centrales supraspinales.
Le dysfonctionnement
des systèmes inhibiteurs
Il ne fait plus aucun doute que la perception de
la douleur dépend de l’intégration de mécanis-
mes endogènes excitateurs et inhibiteurs. L’ab-
sence de douleur peut donc résulter d’une
absence de nociception ou de l’activation des
systèmes inhibiteurs. Il en va de même pour les
douleurs neuropathiques. Ces dernières peuvent
s’expliquer par une hyperactivité centrale,
comme dans le cas de la sensibilisation spinale,
mais également par une absence ou un déficit
des systèmes inhibiteurs endogènes qui ne fil-
trent plus les afférences et laissent place à l’hy-
peralgésie et à l’allodynie. Il est donc important
de comprendre ces mécanismes excitateurs et
inhibiteurs pour élaborer des stratégies théra-
peutiques.
Le rôle des différentes structures du tronc
cérébral dans la modulation de la douleur à la
suite de stimulations nociceptives est docu-
menté depuis plusieurs années. Le concept du
contrôle inhibiteur diffus nociceptif (CIDN)
a été proposé à la fin des années 1970 (Le Bars
et coll. 1979). Ce modèle s’appuie sur une
observation selon laquelle la stimulation noci-
ceptive localisée peut induire une hypoalgésie
généralisée du reste du corps (soit une analgé-
sie par contre-irritation). Dans le modèle du
CIDN, Le Bars et coll. ont émis l’hypothèse
voulant que la stimulation nociceptive, en plus
de conduire l’information nociceptive vers les
centres supérieurs par la voie spinothalamique,
envoie des afférences vers différents centres du
tronc cérébral, dont la substance grise péri-
aqueducale (SGPA) et les noyaux du raphé
(NR). Ces centres transmettent à leur tour des
efférences inhibitrices sérotoninergiques et
noradrénergiques vers les interneurones enké-
phalinergiques des différents niveaux spinaux
et produisent ainsi une inhibition diffuse.
INTRODUCTION
Origine périphérique
Mononeuropathies
n Infectieuse (zona)
n Tic (névralgie) du trijumeau
n Compression nerveuse et inflammation
(radiculopathie et syndrome du canal
carpien)
n Traumatique (section d’un nerf,
postopératoire)
Polyneuropathies
n Métabolique (diabète, hypothyroïdie et
urémie)
n Médicamenteuse (certains agents
antinéoplasiques, isoniazide et certains
agents anti-VIH)
n Toxique (alcool)
n Infectieuse (VIH)
n Déficience en vitamines
n Héréditaire
n Autres : vasculite, etc.
Origine centrale
n AVC (90 % des cas)
n Sclérose en plaques
n Section ou compression de la moelle
(traumatique, tumorale, etc.)
n Autres : épilepsie, syringomyélie,
maladie de Parkinson, etc.
Origine mixte
(centrale et périphérique)
n Syndrome de douleur régionale
complexe
n Membre fantôme
n Syndrome de la queue de cheval
Tableau I :
Exemples selon l’étiologie
de tableaux cliniques causant
des douleurs neuropathiques

3
Chez l’animal, la lésion du funiculus dorso-
latéral, la principale voie efférente du système
inhibiteur descendant, produit une hyperalgie.
Ce phénomène suggère que le CIDN exerce
une inhibition tonique du message nociceptif
dans des conditions normales. Certaines affec-
tions cliniques impliqueraient un déficit des
systèmes inhibiteurs qui se traduirait par des
douleurs spontanées et une hyperalgésie géné-
ralisée. Par exemple, la présence d’une faible
concentration en sérotonine et (ou) en nora-
drénaline dans le liquide céphalorachidien de
certains patients souffrant de douleurs chro-
niques soulève la possibilité d’un déficit de ces
mécanismes inhibiteurs. De récentes études
appuient le rôle d’un déficit des mécanismes
endogènes de contrôle de la douleur en pré-
sence de certains troubles, comme la fibro-
myalgie, les céphalées de tension et le syn-
drome du côlon irritable, et dans quelques cas
d’ostéoarthrite.
Les douleurs neuropathiques :
mécanismes excitateurs
et inhibiteurs
Les douleurs neuropathiques peuvent ainsi pro-
venir d’une amplification des mécanismes exci-
tateurs, mais aussi d’un dysfonctionnement des
mécanismes inhibiteurs toniques et phasiques.
Le fait de bien comprendre les mécanismes exci-
tateurs et inhibiteurs descendants permet de
mieux cerner le rôle potentiel de certains médi-
caments visant à réduire l’hyperactivité des
mécanismes excitateurs, les anticonvulsivants
par exemple, ou encore de stimuler les mécanis-
mes inhibiteurs en utilisant des médicaments
sérotoninergiques et noradrénergiques, notam-
ment certains antidépresseurs.
La prévalence et le diagnostic
La prévalence
Bien que nous ne disposions pas de données
précises, la douleur neuropathique touche de
nombreux Canadiens. En effet, les personnes
atteintes du diabète, d’une radiculopathie ou du
syndrome du canal carpien, infectées par le VIH,
présentant un zona ou ayant subi une chirurgie
ou une chimiothérapie souffrent, dans des pro-
portions allant de 8 % à 55 %, de douleur neu-
ropathique.
Le diagnostic
Le diagnostic de la douleur neuropathique est
essentiellement clinique. Il se fonde sur les anté-
cédents du patient, les symptômes qu’il décrit
et son examen physique. Des outils de dépistage
peuvent être utiles pour préciser le diagnostic.
Chez certains patients, une investigation radio-
logique et électrophysiologique peut être néces-
saire.
Les descripteurs verbaux de la douleur consti-
tuent le premier outil de dépistage. Parmi les
échelles et les questionnaires d’évaluation, le
DN4 (la douleur neuropathique en quatre ques-
tions) peut être utile au diagnostic. Ces ques-
tions portent sur 10 éléments : 7 éléments aux-
quels le patient doit répondre par oui ou non et
3 liés à l’examen physique. Chaque réponse
positive ajoute un point. Un score de 4 points et
plus sur 10 oriente vers un diagnostic de douleur
neuropathique probable (sensibilité : 82,9 %;
spécificité : 89,9 %).
La méthodologie
Le présent algorithme de traitement est proposé
par un forum spécial formé de la Dre Aline Bou-
langer (anesthésiologiste, présidente) et, par
ordre alphabétique, des Drs Pierre Arsenault
(omnipraticien), Alain Béland (anesthésiolo-
giste), André Bélanger (omnipraticien), Chris-
tian Cloutier (neurochirurgien), Dominique
Dion (omnipraticienne), Pierre Dolbec (anes-
thésiologiste), Angela Genge (neurologue),
David Lussier (gériatre), Serge Marchand (neu-
rophysiologiste), Huu Tram Anh Nguyen (anes-
thésiologiste) et Mark Ware (omnipraticien), de
même que de M. Robert Thiffault (pharma-
cien).
Le groupe s’est réuni le lundi 26 novembre
2007. Chaque membre était chargé de présenter
aux autres une revue de la documentation médi-
cale sur le sujet ou la classe médicamenteuse qui
lui avait été assigné, ses pratiques et ses recom-
mandations à inclure à l’algorithme. Au terme
des présentations, le groupe a élaboré l’algo-
rithme officiel après avoir débattu jusqu’à ce
qu’il y ait consensus.
Bien que les recherches sur le sujet se soient
multipliées ces dernières années, les études
ayant comparé différents médicaments ou
classes de médicaments entre eux ou évalué
l’efficacité des différentes associations de
médicaments proposées sont encore très peu
nombreuses. Plusieurs des recommandations
émises dans le présent article sont par consé-
quent fondées sur l’expérience clinique des
auteurs et sur les recommandations des experts
internationaux.
Interrogatoire du patient
Question 1 :
La douleur présente-t-elle une ou plusieurs des caractéristiques suivantes ?
1. Brûlure
2. Sensation de froid douloureux
3. Décharges électriques
Question 2 :
La douleur est-elle associée dans la même région à un ou
plusieurs des symptômes suivants ?
4. Fourmillements
5. Picotements
6. Engourdissements
7. Démangeaisons
Examen du patient
Question 3 :
La douleur est-elle localisée dans un territoire où l’examen met en évidence :
8. Une hypoesthésie au tact ?
9. Une hypoesthésie à la piqûre ?
Question 4 :
La douleur est-elle provoquée ou augmentée par :
10. Le frottement ?
Oui = 1 point Non = 0 point Score du patient : /10
Tableau tiré de Bouhassira D et coll. Pain 2005; 114:29-36.
Tableau II : Le questionnaire DN4
Algorithme de traitement de la douleur neuropathique

4
Algorithme de traitement de la douleur neuropathique
La figure 1 présente l’algorithme de traitement
de la douleur neuropathique tel qu’il a été éta-
bli après consensus par le forum québécois
spécial.
Des médicaments de première, deuxième,
troisième et quatrième lignes y sont proposés.
Une fois le diagnostic établi, il est habituelle-
ment recommandé de prescrire un agent de
première ligne en monothérapie. Lorsque la
douleur est intense, les opioïdes ou le trama-
dol à courte durée d’action peuvent être asso-
ciés aux médicaments de première ligne pour
permettre de mieux soulager le patient en
attendant que la titration des agents de pre-
mière ligne soit complétée. Si toutefois la
douleur est moins intense, les opioïdes ou le
tramadol peuvent être utilisés en deuxième
ligne en monothérapie ou en association.
En général, l’agent de première ligne est pres-
crit à petite dose, que l’on augmente graduelle-
ment en fonction de la réaction et des effets indé-
sirables. Si le premier agent choisi se révèle
inefficace à des doses thérapeutiques ou est mal
toléré par le patient, il convient de le substituer
par un autre agent de première ligne d’une autre
classe.
Si ces médicaments n’apportent qu’un soula-
gement partiel, il est justifié de les associer à un
deuxième agent proposé en première ligne et
dont le site d’action est différent. Si l’ajout du
nouvel agent ne procure pas de soulagement, il
convient de le sevrer et de poursuivre le traite-
ment à l’aide des agents de deuxième, de troi-
sième, puis de quatrième ligne. La figure 1 et
les tableaux III, IV et V présentent respective-
ment l’algorithme de traitement suggéré, les
indications et contre-indications, les coûts, les
précautions, les effets indésirables, la posologie
et la liste des médicaments non couverts par le
régime d’assurance maladie du Québec
(RAMQ).
Lorsque le traitement parvient à soulager la
douleur du patient de façon satisfaisante, il est
recommandé de le poursuivre pendant au moins
six mois avant de tenter de sevrer graduellement
un agent à la fois. Souvent, le patient lui-même
indique à son médecin lorsqu’il est prêt pour le
sevrage. Celui-ci se poursuit tant que le patient
ne ressent pas de douleur. Si le retrait d’un agent
fait ressurgir la douleur, il convient de le prescrire
de nouveau à la dose minimale efficace et de ten-
ter de sevrer un autre agent. Lorsque les doses
Figure 1 : Algorithme de traitement de la douleur neuropathique
Utiliser les courtes actions
en 1re ligne en association
avec les autres agents de 1re
ligne en présence des
situations suivantes :
nsoulagement rapide
pendant la titration des
agents de 1re ligne
(jusqu’à la posologie
efficace);
népisodes d’exacerbation
grave de la douleur;
ndouleur neuropathique
aiguë;
ndouleur neuropathique
liée au cancer.
Utiliser en 2e ligne en monothérapie ou en
association (lorsqu’une utilisation à long terme est
envisagée, favoriser l’administration d’agents à
longue durée d’action).
α Indiqués en première ligne chez les patients âgés de moins de 60 ans. Chez les patients âgés de
60 ans et plus, éviter les amines tertiaires de la classe des tricycliques en raison de leurs effets
anticholinergiques. La nortriptyline et la désipramine peuvent leur être prescrites avec précaution, à
faible dose.
β Indiquée en cas de douleur périphérique et d’allodynie. Ne pas appliquer sur une surface excédant
300 cm2 (soit l’équivalent d’une demi-feuille) en raison des dangers liés à l’absorption systémique.
La lidocaïne peut être utilisée en association avec toutes les classes de médicaments. Toutefois, les
associations les plus fréquemment citées dans la documentation médicale sont lidocaïne et
anticonvulsivants, et lidocaïne et antidépresseurs.
χ Il n’y a pas d’avantage à prescrire les IRSN si les antidépresseurs tricycliques ou tétracycliques
administrés à des doses optimales se sont révélés inefficaces. Toutefois, les IRSN sont indiqués en
première intention en présence d’une dépression majeure, d’une intolérance aux antidépresseurs
tricycliques et tétracycliques, ou d’une contre-indication à l’usage de ces derniers.
Cas particuliers
n Insuffisance rénale : éviter ou ajuster la posologie à la baisse des médicaments dont l’élimination
est principalement rénale (p. ex., gabapentinoïdes, IRSN, tramadol, lévétiracétam, topiramate)
ou dont les métabolites actifs sont excrétés par les reins (p. ex., morphine).
n Obésité/diabète : le topiramate peut se révéler un agent intéressant grâce à une perte de poids
potentielle.
1re ligne
Gabapentinoïdes
Prégabaline
Gabapentine
Antidépresseurs
tricycliques
ou tétracycliques α
Amines tertiaires :
Amitriptyline
Clomipramine
Imipramine
Amines
secondaires :
Nortriptyline
Désipramine
Tétracyclique :
Maprolitine
Anesthésique local
Lidocaïne topique à
10 % β
2e ligne
IRSN χ
Venlafaxine
Duloxétine
Cannabinoïdes
Dronabinol
Nabilone
THC/CBD par voie
buccale
3e ligne
ISRS
Citalopram
Paroxétine
Autre
antidépresseur
Bupropion
Autres
anticonvulsivants
Topiramate
Carbamazépine
Lévétiracétam
Lamotrigine
4e ligne
Méthadone
Kétamine
Mexilétine
Baclofène
Clonidine
Clonazépam
À déconseiller :
Mépéridine
Phénytoïne
Opioïdes ou tramadol
➡
➡
➡
➡
ALGORITHME
DE TRAITEMENT DE
LA DOULEUR NEUROPATHIQUE
(Suite à la page 7)

5
Algorithme de traitement de la douleur neuropathique
Médicaments
PREMIÈRE LIGNE
Gabapentinoïdes
Prégabaline
Gabapentine
Antidépresseurs
tricycliques (ADT)
ou tétracycliques
Amitriptyline
Clomipramine
Imipramine
Nortriptyline
Désipramine
Maprolitine
Crème topique
Lidocaïne à 10 %
Opiacés
Oxycodone
Morphine
Hydromorphone
Fentanyl
Codéine
Analgésique opiacé
Tramadol
Indications officielles
➠ Douleur neuropathi-
que associée à la
neuropathie diabétique
périphérique ou aux
névralgies post-
herpétiques et douleur
neuropathique d’origine
centrale chez l’adulte
➠ Traitement adjuvant
de l’épilepsie
Dépression
Soulagement de la
douleur
Analgésique
Précautions
Effets de classe :
Ajuster la dose en
présence d’insuffisance
rénale
Prudence si insuffisance
cardiaque de classe III
ou IV
Effets de classe :
T
roubles cardiaques,
effets centraux,
glaucome, risque
suicidaire, vision
brouillée, rétention
urinaire, bouche sèche
Possibilité de syndrome
sérotoninergique si
associés à certains
autres antidépresseurs
ou au tramadol
Peau lésée, inflamma-
toire; entraîne une
pénétration cutanée
accrue
Effets de classe :
Antécédents de
toxicomanie, MPOC,
apnées du sommeil,
risque suicidaire,
insuffisance rénale
(principalement pour la
morphine)
Ajuster la dose en pré-
sence d’insuffisance
rénale
Possibilité de syndrome
sérotoninergique et de
convulsions si associé à
certains antidépresseurs
Il faut tenir compte de la
dose totale d’acétami-
nophène chez les
patients qui en
consomment et à qui on
prescrit du Tramacet
(tramadol et
acétaminophène)
Contre-indications*
Effets de classe :
Bloc de branche
gauche, bifasciculaire,
intervalle QT prolongé,
maladie ischémique
modérée ou grave (la
prise concomitante
d’antiarythmiques de
classe I élève le risque
de décès), insuffisance
cardiaque, infarctus
récent, glaucome à
angle étroit
Contre-indiqué en
association avec un
IMAO
Les formulations à
libération lente sont
contre-indiquées chez
les patients souffrant
d’une grave insuffisance
rénale
Pour les formulations à
courte durée d’action,
ne pas dépasser
2 comprimés aux
12 h si
a ClCr < 30 mL/min
Effets indésirables
Effets de classe :
Étourdissements,
somnolence, œdème
périphérique, confusion,
bouche sèche, vision
trouble, ataxie,
céphalée, nausées, gain
pondéral, myoclonies,
dystonie, astérixis
Effets de classe :
Centraux : fatigue,
sédation, baisse de la
vigilance, confusion,
anxiété
Périphériques : vision
trouble, constipation,
dysurie, tremblements,
gain pondéral,
hypotension,
dysfonctionnement
sexuel
Risque de toxicité aux
anesthésiques locaux si
utilisée sur une grande
surface
Effets de classe :
Nausées, vomissements,
somnolence, étourdis-
sements, constipation,
diaphorèse, prurit,
myoclonies, dépression
respiratoire, hyperalgésie
aux opioïdes,
hypogonadisme
Étourdissement,
nausées, vomissements,
constipation,
somnolence
Interactions
médicamenteuses
➠
Aucune connue
➠
Les solutions
antacides nuisent à
l’absorption de la
gabapentine
Effets de classe :
nInteractions
médicamenteuses
nombreuses,
antiarythmiques de
classe Ia, flumazénil,
IMAO, pimozide
nL’association avec le
bupropion diminue le
seuil de convulsion.
nLe risque d’hypoten-
sion orthostatique
augmente si on associe
les ADT avec la clonidine
La codéine et
l’oxycodone sont
métabolisés en partie
par le CYP405 2D6
Le fentanyl est
métabolisé par le
CYP450 3A4
Le tramadol est
métabolisé en partie
par le CYP450 2D6
Demi-vie moindre en
association avec un
inducteur du CYP 3A4
Coût**
$$-$$$
$-$$
$-$$$
Autres :
$-$$$
$$$
Tableau III : Les médicaments contre la douleur neuropathique
(Suite du tableau à la page suivante)
* Tous les médicaments sont contre-indiqués en présence de signes d’hypersensibilité au
principe actif ou à tout autre ingrédient ou en cas de grossesse et d’allaitement.
Toutefois, les antidépresseurs tricycliques semblent être plus sûrs que les autres options
chez la femme enceinte.
** Coût d’une posologie moyenne selon liste de février 2008 de la RAMQ ou le coût
d’acquisition du pharmacien communautaire (ne comprenant pas les honoraires du
pharmacien).
$ = moins de 50 $ par mois; $$ : entre 50 et 100 $ par mois; $$$ : plus de 100 $ par mois
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%