Électrophorèse sur gel d`agarose - EU

WORLD HEALTH ORGANIZATION
REGIONAL OFFICE FOR EUROPE
WELTGESUNDHEITSORGANISATION
REGIONALBÜRO FÜR EUROPA
ORGANISATION MONDIALE DE LA SANTE
BUREAU REGIONAL DE L'EUROPE
ВСЕМИРНАЯ ОРГАНИЗАЦИЯ ЗДРАВООХРАНЕНИЯ
ЕВРОПЕЙСКОЕ РЕГИОНАЛЬНОЕ БЮРО
Analyse d’échantillons alimentaires pour la
présence d’organismes génétiquement modifiés
Module 5
Électrophorèse sur gel d’agarose
M. Somma, M. Querci

Électrophorèse sur gel d’agarose 2
Analyse d’échantillons alimentaires pour la présence d’organismes génétiquement modifiés Module 5
Table des matières
Module 5
Électrophorèse sur gel d’agarose
INTRODUCTION 3
PRINCIPES PHYSIQUES DE L’ELECTROPHORESE SUR GEL D’AGAROSE 3
COMPOSANTS DE L’ELECTROPHORESE SUR GEL D’AGAROSE 6
EXPERIENCE 8
REFERENCES 12

Électrophorèse sur gel d’agarose 3
Analyse d’échantillons alimentaires pour la présence d’organismes génétiquement modifiés Module 5
Introduction
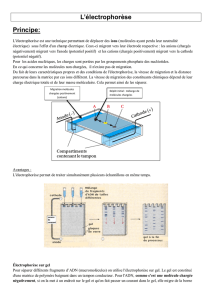
L’électrophorèse sur gel est une méthode de séparation des macromolécules en
fonction de leur taille, de leur charge électrique et d’autres propriétés physiques. Le
terme « électrophorèse » décrit la migration de particules chargées sous l’influence
d’un champ électrique. Le préfixe « électro » fait référence à l’électricité et la racine
« phorèse » vient du grec phoros, qui signifie « porter d’un côté à l’autre ».
L’électrophorèse sur gel fait référence à une technique où les molécules sont
obligées de traverser une couche de gel sous l’impulsion d’un courant électrique.
L’énergie motrice de l’électrophorèse est la tension qui est appliquée à des
électrodes placées de part et d’autre de la couche de gel. Les propriétés d’une
molécule déterminent la rapidité avec laquelle un champ électrique peut traverser un
milieu gélatineux.
Diverses macromolécules biologiques importantes (ex.: acides aminés, peptides,
protéines, nucléotides et acides nucléiques) possèdent des groupes ionisables qui, à
un pH donné, se transforment en espèces chargées électriquement sous forme
tantôt de cations (+), tantôt d’anions (-). En fonction de la nature de la charge du
réseau, les particules chargées migreront soit vers la cathode, soit vers l’anode. À
titre d’exemple, lorsqu’un champ électrique traverse un gel de pH neutre, les groupes
de phosphates chargés négativement de l’ADN provoquent la migration de celui-ci
vers l’anode (Westermeier, 1997).
L’électrophorèse à travers l’agarose est une méthode utilisée de façon standard pour
séparer, identifier et purifier des fragments d’ADN. La technique est simple et facile à
réaliser et peut dissoudre des fragments d’ADN que d’autres procédures ne
permettent pas de séparer correctement. La position de l’ADN dans le gel peut, par
ailleurs, être déterminée en teintant celui-ci avec une faible concentration de bromure
d’éthidium, un fluorochrome s’intercalant entre les bases de l’ADN.
Les paragraphes suivants présenteront les principes physiques, les composants
(matrice du gel, tampon, tampon de charge et marqueur) et les méthodes de
préparation de l’électrophorèse sur gel d’agarose (Sambrook et al., 1989).
Principes physiques de l’électrophorèse sur gel d’agarose
La technique de l’électrophorèse sur gel est utilisée pour séparer les acides
nucléiques et les protéines. La séparation de macromolécules dépend de deux
variables : la charge et la masse. Lorsqu’un échantillon biologique tel qu’un ADN est
mélangé à une solution tampon et appliqué sur un gel, il se produit une interaction

Électrophorèse sur gel d’agarose 4
Analyse d’échantillons alimentaires pour la présence d’organismes génétiquement modifiés Module 5
des deux variables. Les molécules repoussées d’un côté par le courant électrique
produit par une électrode sont attirées simultanément par le courant produit par
l’autre électrode. La force de friction du matériau composant le gel joue le rôle de
« tamis moléculaire » et sépare les molécules en fonction de leur taille. Durant
l’électrophorèse, les macromolécules sont poussées à travers les pores. Leur vitesse
de migration à travers le champ électrique dépend des facteurs suivants :
• la résistance du champ,
• la taille et la forme des molécules,
• l’hydrophobicité relative des échantillons,
• la force ionique et la température du tampon dans lequel les molécules se
déplacent.
Afin de bien comprendre la séparation des particules chargées dans l’électrophorèse
sur gel, il est important d’examiner de plus près les équations simples applicables à
l’électrophorèse. Lorsqu’une tension est appliquée entre les électrodes, un gradient
de potentiel E est généré et peut être exprimé par l’équation
E = V/d (1)
où V, mesuré en volts, désigne la tension appliquée et d, la distance en cm entre les
électrodes.
Lorsque le gradient de potentiel E est appliqué, une force F est générée sur une
molécule chargée et exprimée par l’équation :
F = Eq (2)
où q est égal à la charge en coulombs qui pèse sur la molécule. C’est cette force,
mesurée en newtons, qui pousse une molécule chargée vers une électrode.
Il existe également une résistance de friction qui ralentit le mouvement des
molécules chargées. Cette force de friction est fonction de :
• la taille hydrodynamique de la molécule,
• la forme de la molécule,
• la taille de pore du milieu dans lequel se produit l’électrophorèse,
• la viscosité du tampon.
La vélocité v d’une molécule chargée dans un champ électrique est fonction du
gradient de potentiel, de la charge et de la force de friction de la molécule et peut
être exprimée par l’équation :
v = Eq / f (3)
où f indique le coefficient de friction.
La mobilité électrophorétique M d’un ion peut alors être définie par la vélocité de l’ion
divisée par le gradient de potentiel :

Électrophorèse sur gel d’agarose 5
Analyse d’échantillons alimentaires pour la présence d’organismes génétiquement modifiés Module 5
M = v / E (4)
L’équation (3) permet, en outre, de voir que la mobilité électrophorétique M peut être
exprimée de manière équivalente comme étant la charge de la molécule q divisée
par le coefficient de friction f :
M = q / f. (5)
Lorsqu’une différence potentielle s’applique, les molécules dotées de différentes
charges globales vont commencer à se séparer en raison de leur mobilité
électrophorétique différente. Cette mobilité électrophorétique est un paramètre
important et caractéristique d’une molécule ou d’une particule chargée et dépend de
la valeur pK du groupe chargé et de la taille de la molécule ou de la particule. Même
des molécules ayant des charges similaires commenceront à se séparer si elles ont
des tailles moléculaires différentes, attendu qu’elles auront des forces de friction
différentes. L’ADN linéaire à deux brins traverse les matrices de gel à des vitesses
qui sont inversement proportionnelles au log10 du nombre de paires de base. Les
molécules de plus grosse taille migrent plus lentement en raison de leur plus grande
traînée de frottement et de leur mouvement moins efficace à travers les pores du gel.
Le courant traversant la solution entre les électrodes est conduit principalement par
les ions du tampon, une faible proportion étant conduite par les ions de l’échantillon.
La relation entre le courant I, la tension V et la résistance R est exprimée comme
dans la loi d’Ohm :
R = V / I. (6)
Cette équation démontre que pour une résistance donnée R, il est possible
d’accélérer une séparation électrophorétique en augmentant la tension V appliquée,
ce qui pourrait engendrer une augmentation correspondante de la circulation du
courant I. La distance parcourue lors de la migration sera proportionnelle au courant
et au temps. L’augmentation de la tension V et l’augmentation correspondante du
courant I provoqueront cependant l’un des principaux problèmes posés par la plupart
des formes d’électrophorèse, en l’occurrence la génération de chaleur. Ceci peut être
illustré par l’équation suivante où le courant W (mesuré en watts) généré durant
l’électrophorèse est égal au produit de la résistance multiplié par le carré du courant :
W = I2R. (7)
Vu que la plus grande partie de l’électricité produite dans le processus
électrophorétique est dissipée sous forme de chaleur, les effets préjudiciables
suivants peuvent se produire:
• un taux accru de diffusion d’ions d’échantillon et d’ions de tampon, entraînant un
élargissement des échantillons séparés ;
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%